氯吡苯脲是一种经国家批准使用的植物生长调节剂,其结构简式如图所示。
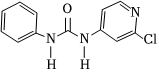
(1)下列方法中,可用于测量氯吡苯脲相对分子质量的是 AA。(单选)
A.质谱
B.红外光谱
C.核磁共振氢谱
D.原子发射光谱
(2)基态O原子价层电子轨道表示式不能表示为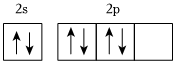 ,因为这违背了 CC。(单选)
,因为这违背了 CC。(单选)
A.构造原理
B.泡利不相容原理
C.洪特规则
(3)氯吡苯脲的组成元素中,属于第二周期的元素,其第一电离能由大到小的顺序为 N>O>CN>O>C。(用元素符号表示)
(4)氯元素基态原子的电子排布式为 1s22s22p63s23p51s22s22p63s23p5。其原子核外电子占据的最高能级的电子云轮廓图为 哑铃哑铃形。
(5)氮原子最外层电子中两种自旋状态的电子数之比为:4:1或1:44:1或1:4。氮元素在元素周期表中属于 pp区元素。
(6)和碳原子相比,氮原子的电负性更 大大(填“大”或“小”),从原子结构角度解释其原因:N原子半径比C小、核电荷数比C大,对电子吸引更强,电负性更大N原子半径比C小、核电荷数比C大,对电子吸引更强,电负性更大。
(7)查文献可知,可用异氰酸苯酯与2-氯-4-氨基吡啶反应,生成氯吡苯脲,其反应方程式为: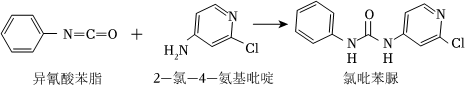
①该反应的反应类型为 加成反应加成反应。
②反应过程中,每生成1个氯吡苯脲,断裂 11个σ键,断裂 11个π键。
氯吡苯脲能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等。
(8)H2O分子中的H—O—H键角为104.5°,则NH3分子中的H—N—H键角 >>(填“>”、“<”或“=”)104.5°。
(9)请从化学键的角度解释H2O分子比NH3分子稳定的原因:H—O键的键能大于H—N键的键能,所以分子比NH3分子稳定H—O键的键能大于H—N键的键能,所以分子比NH3分子稳定。
(10)CO2的水溶液中含有CO2-3,CO2-3的空间构型为 平面正三角形平面正三角形,中心原子的杂化类型为 sp2sp2。
(11)氨气溶于水时,大部分NH3与H2O用氢键(用“•••”表示)结合形成NH3•H2O分子。根据氨水的性质可推知NH3•H2O的结构式为 BB。(单选)

CO
2
-
3
CO
2
-
3
【答案】A;C;N>O>C;1s22s22p63s23p5;哑铃;4:1或1:4;p;大;N原子半径比C小、核电荷数比C大,对电子吸引更强,电负性更大;加成反应;1;1;>;H—O键的键能大于H—N键的键能,所以分子比NH3分子稳定;平面正三角形;sp2;B
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/22 8:0:9组卷:86引用:1难度:0.6


