某同学通过查阅资料得知,可利用Na2SO3粉末与70%硫酸溶液在加热条件下反应来快速制取SO2。该同学设计了如图所示装置制取SO2并验证其性质。
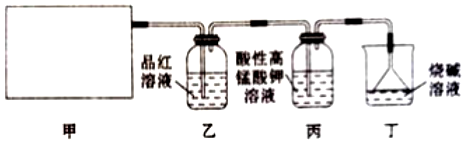
回答下列问题:
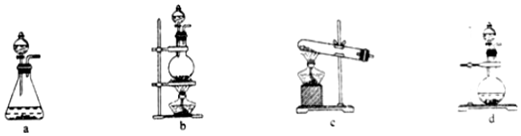
(1)根据资料中的相关信息,甲装置应选择下列装置中的 bb(填序号)。
(2)实验过程中,丙装置中酸性高锰酸钾溶液紫红色褪去,说明SO2具有 还原还原性,证明SO2具有漂白性的现象为 乙装置中品红溶液褪色乙装置中品红溶液褪色。
(3)丁装置的作用是 吸收多余的SO2,防止污染空气吸收多余的SO2,防止污染空气。写出其中发生主要反应的化学方程式:SO2+2NaOH=Na2SO3+H2OSO2+2NaOH=Na2SO3+H2O。
【答案】b;还原;乙装置中品红溶液褪色;吸收多余的SO2,防止污染空气;SO2+2NaOH=Na2SO3+H2O
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/12 8:0:9组卷:3引用:1难度:0.7


