2023年江苏省扬州市高邮市树人学校中考化学三模试卷
发布:2024/6/22 8:0:10
一、选择题:本题包括20小题,每小题2分,共计40分。每小题只有一个选项符合题意。
-
1.纤维素属于糖类,纤维素中不含有的元素是( )
组卷:23引用:3难度:0.5 -
2.近日多项非物质文化遗产走进“樱花大道”,下列过程涉及化学变化的是( )
组卷:37引用:4难度:0.8 -
3.王亚平在中国空间站表演“五环魔术”,她往碳酸钠溶液中加入溴百里酚蓝试剂,呈现鲜亮的蓝色。若将溴百里酚蓝加入盐酸中,则会呈现黄色。下列说法错误的是( )
组卷:25引用:5难度:0.5 -
4.下列物质由离子构成的是( )
组卷:16引用:4难度:0.6 -
5.氧气是空气的主要成分之一。下列说法不正确的是( )
组卷:110引用:5难度:0.6 -
6.关于下列符号或图示的说法正确的是( )
①2H②Al3+③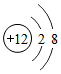 ④
④ 组卷:70引用:11难度:0.5
组卷:70引用:11难度:0.5 -
7.泡腾片放入水中,产生很多气泡。其原理是,泡腾片中的柠檬酸(C6H8O7)和碳酸氢钠(NaHCO3)在水中发生了如下反应:C6H8O7+3NaHCO3═C6H5O7Na3+3H2O+3X↑,其中X的化学式是( )
组卷:48引用:6难度:0.6 -
8.培养垃圾分类的好习惯,为改善生活环境作努力。空的塑料矿泉水瓶应投入的垃圾箱上所印标识是( )
组卷:178引用:8难度:0.8
二、非选择题
-
24.阅读下面科普短文
说起二氧化硫(SO2),你可能首先想到它是空气质量播报中提及的大气污染物。其实你真的了解SO2吗?难道它只是有害物质吗?
一、SO2与食品工业
SO2作为防腐剂、漂白剂和抗氧化剂广泛用于食品行业。葡萄酒酿制中适量添加SO2,可防止葡萄酒在陈酿和贮藏过程中被氧化,抑制葡萄汁中微生物的活动。食糖加工过程中可使用SO2进行脱色。按照我国《食品添加剂使用标准(GB2760-2014)》,合理使用SO2不会对人体健康造成危害。
标准中部分食品SO2的最大残留量
(1)按照国家标准,食糖中的SO2最大残留量为食品 蜜饯 葡萄酒 食糖 水果干 巧克力 果蔬汁 最大残留量 0.35g/kg 0.25g/L 0.1g/kg 0.1g/kg 0.1g/kg 0.05g/kg g/kg。
(2)葡萄酒酿制过程中SO2的作用是。
二、SO2与硫酸工业
硫酸是重要的化工原料,工业制硫酸的关键步是SO2的获取和转化。工业上以黄铁矿(主要成分为FeS2,已知:4FeS2+11O22Fe2O3+8SO2)为原料生产硫酸的工艺流程如图所示。硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨。工业上可先用氨水吸收,生成亚硫酸铵,再用硫酸处理,将重新生成的SO2循环利用。高温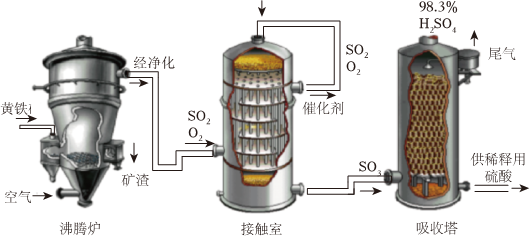
(3)接触室中发生的化学方程式为。
(4)依据生产硫酸的工艺流程图,下列说法正确的是(填字母序号)。
A.为使黄铁矿充分燃烧,需将其粉碎
B.催化剂能够提高SO2的反应速率和产量
C.吸收塔中得到的产品为纯净物
D.沸腾炉排出的矿渣可用于炼铁
(5)接触室中的SO2平衡转化率与温度及压强的关系如图。催化剂活性与温度的关系见图。在实际生产中,SO2催化氧化反应的条件选择常压和450℃(对应图史A点),而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是。
SO2平均转化率与温度、压强的关系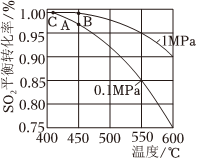
催化剂活性与温度的关系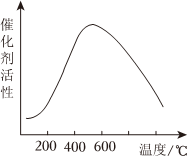
(6)写出用氨水吸收SO2的化学方程式。
三、SO2与化石燃料
化石燃料中的煤通常含有硫元素,直接燃烧会产生SO2,为了减少煤燃烧产生的SO2污染空气,可以采取“提高燃煤质量,改进燃烧技术”的措施,例如,对燃煤进行脱硫、固硫处理;还可以采取“优化能源结构、减少燃煤使用”的措施。碳酸钙、碱石灰(NaOH和CaO的混合物)等作为吸收剂可以对燃煤烟气进行脱硫处理,利用数字化实验可以来测定燃煤烟气中SO2的含量,得到如图所示的SO2含量与时间的关系曲线图。依据文章内容回答下列问题。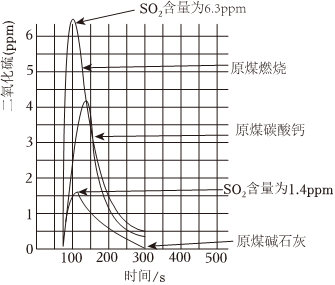
(7)由图可知,脱硫效率较高的吸收剂是。
(8)利用碱石灰吸收SO2时,下列措施能使脱硫效率提高的是(填序号)。
A.将原煤与碱石灰粉碎,混合均匀
B.将碱石灰的用量适当增加
C.将时间300s变为500s
(9)下列措施能减少SO2排放的是(填序号)。
A.对燃煤进行脱硫
B.推广煤改气、煤改电
C.循环利用工业尾气中的SO2组卷:123引用:3难度:0.5 -
25.铁的氧化物有氧化亚铁、氧化铁和四氧化三铁等,在工业上有很多用途。
Ⅰ.四氧化三铁是一种常用的磁性材料,由工业废料铁泥(含Fe、Fe2O3、FeO和杂质,杂质不参与反应)制取Fe3O4的一种流程如图。(已知:Fe+Fe2(SO4)3=3FeSO4)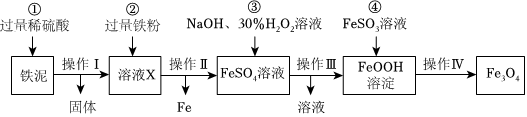
(1)步骤①加入过量稀硫酸和铁泥反应,生成硫酸亚铁的化学方程式。(写一个)
(2)步骤②加入过量铁粉的目的。步骤③中反应温度不宜过高的原因是,在进行操作Ⅲ时,需要用到的玻璃仪器有烧杯、玻璃棒和。
Ⅱ.高纯氧化铁(Fe2O3)又称“引火铁”,在现代工业上有广泛应用前景。以下是用赤铁矿(含少量不溶于水也不溶于酸的SiO2等)为原料,制备高纯氧化铁的生产流程示意图,请回答: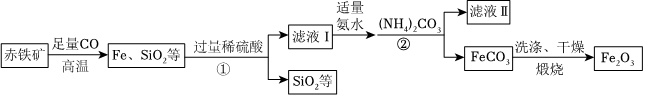
【资料卡片】
氨水呈碱性(主要成分NH3•H2O是一种碱);(NH4)2CO3溶液显碱性,40℃以上易分解。
FeCO3FeO+CO2↑,4FeO+O2=2Fe2O3高温
(3)根据题中信息,加入(NH4)2CO3后,该反应必须控制的温度条件是。
(4)滤液Ⅱ中可回收的产品是(化学式),该物质在农业上可做氮肥。
(5)有同学认为可以向滤液I中通入CO2和NH3也能实现同样反应。基学习小组利用如图装置模拟此反应。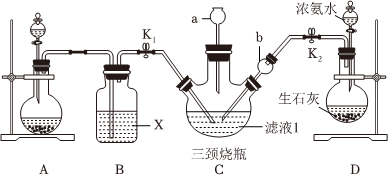
①图A为实验室制备CO2的装置,烧瓶中发生的化学方程式为。
②B装置为除去二氧化碳中的氯化氢气体,洗气瓶中的试剂X可选择(填序号)。
A.NaOH溶液
B.饱和NaHCO3溶液
C.碱石灰
D.浓硫酸
③C装置中长颈漏斗a的作用是,在其上端需要放一团沾有酸液的棉花团其目的是。
(6)写出在空气中煅烧FeCO3生成Fe2O3的化学反应方程式。
(7)FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧46.4t的FeCO3,得到Fe2O3和FeO的混合物31.68t。计算生成Fe2O3质量。(写出计算过程)组卷:112引用:3难度:0.5


