鲁科版(2019)选择性必修1《2.4 化学反应条件的优化——工业合成氨》2023年同步练习卷(9)
发布:2024/8/17 5:0:1
一、选择题
-
1.合成氨厂所需H2可由焦炭与水反应制得,其中有一步反应为CO(g)+H2O(g)═CO2(g)+H2(g)△H<0欲提高CO转化率,可采用的方法是( )
①降低温度;②增大压强;③使用催化剂;④增大CO浓度;⑤增大水蒸气浓度.组卷:103引用:14难度:0.9 -
2.在容积可变的密闭容器中,2mol N2和8mol H2在一定条件下发生反应,达到平衡时,H2的转化率为30%,则平衡时氮气的体积分数为( )
组卷:7引用:3难度:0.7 -
3.工业上合成氨时一般采用500℃左右的温度,其原因是( )
①适当提高氨的合成速率
②提高H2的转化率
③提高氨的产量
④催化剂在500℃时的活性最大组卷:42引用:4难度:0.8 -
4.CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列设计方案可以提高尾气处理效果的是( )
①选用适当的催化剂 ②提高装置温度 ③降低装置的压强 ④装置中放入碱石灰.组卷:31引用:12难度:0.9 -
5.常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)═Ni(CO)4(g)△H<0 230℃时,该反应的平衡常数K=2×10-5.已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断错误的是( )组卷:29引用:4难度:0.7
二、解答题
-
 15.科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3.进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2、压强1.0×105 Pa、反应时间3h):
15.科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3.进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2、压强1.0×105 Pa、反应时间3h):
相应的热化学方程式如下:N2(g)+3H2O(l)⇌2NH3(g)+T/K 303 313 323 353 NH3生成量
/10-6 mol4.8 5.9 6.0 2.0 O2(g)△H=+765.2kJ•mol-132
回答下列问题:
(1)请画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化的示意图,并进行必要标注.
(2)与目前广泛使用的工业合成氨方法相比,该方法固氮反应速率慢.请提出可提高其反应速率且增大NH3生成量的建议:(写两点);.
(3)工业合成氨的反应为N2(g)+3H2(g)高温、高压催化剂
2NH3(g).设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为.47
计算:①该条件下N2的平衡转化率为(保留一位小数).
②该条件下反应2NH3(g)高温、高压催化剂N2(g)+3H2(g)的平衡常数.
③若反应温度不变,假如在容积为2.0L的密闭容器中起始充入0.40mol N2(g)和0.40mol H2(g),反应3min时测得体系压强为原来的,这段时间H2的平均反应速率为34.组卷:12引用:2难度:0.5 -
 16.合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
16.合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
(1)①写出工业合成氨的化学方程式温 度(℃) 360 440 520 K值 0.036 0.010 0.0038 .
②由上表数据可知该反应为放热反应,理由是.
③理论上,为了增大平衡时H2的转化率,可采取的措施是.(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
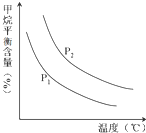
(2)原料气H2可通过反应 CH4(g)+H2O (g)═CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:n(H2O)n(CH4)
①图中,两条曲线表示压强的关系是:P1P2(填“>”、“=”或“<”).
②该反应为反应(填“吸热”或“放热”).
(3)原料气H2还可通过反应CO(g)+H2O(g)═CO2 (g)+H2(g) 获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则平衡时CO的转化率为,该反应平衡常数的表达式为.
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是(填序号).
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO):n (H2O):n (CO2):n (H2)=1:1:1:1.组卷:8引用:3难度:0.3


