2022-2023学年江苏省常州市教育学会高二(下)期末化学试卷
发布:2024/7/6 8:0:9
一、单项选择题:共11小题,每题3分,共39分.每题只有一个选项最符合题意.
-
1.华为5G手机使用的麒麟芯片主要成分是晶体Si。下列固体与其晶体类型相同的是( )
组卷:62引用:1难度:0.9 -
2.Al-空气电池(KOH溶液做电解质)具有很高的能量密度。下列说法不正确的是( )
组卷:42引用:1难度:0.8 -
3.反应2CO+SO2
S+2CO2可用于燃煤烟气脱硫。下列说法正确的是( )高温组卷:36引用:2难度:0.7 -
4.用下列实验装置进行实验,可达到相应的实验目的的是( )
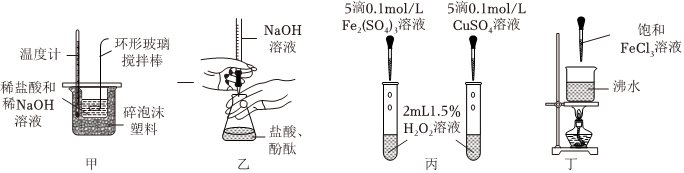 组卷:22引用:1难度:0.5
组卷:22引用:1难度:0.5 -
5.阅读下列材料,完成5~7题:
周期表中ⅤA族元素及其化合物应用广泛。氨是重要的化工原料,工业合成氨反应中每生成1mol氨气,释放92.3kJ热量。“长征二号”运载火箭采用C2H8N2/N2O4作发动机推进剂,燃烧产物无污染。LiFePO4常作锂电池的正极材料,电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4。砷化镓(GaAs)是制备第三代半导体材料Ga2O3的重要原料。
下列说法正确的是( )组卷:20引用:0难度:0.70
二、非选择题:共4题,共61分.
-
16.铜-钢双金属废料和铜烟灰是铜的重要二次资源.
Ⅰ.从铜-钢双金属废料中浸出铜的工艺流程如图: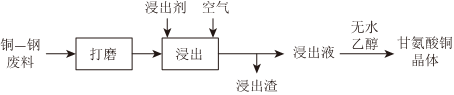
(1)25℃时,随溶液的pH不同,甘氨酸在水溶液中分别以CH2COOH、NH+3CH2COO-或NH2CH2COO-为主要形式存在.内盐NH+3CH2COO-是两性化合物,请用离子方程式表示其水解使水溶液呈碱性的原因:NH+3.
(2)浸出剂的制备:主要原料有甘氨酸(简写为HL)、CuSO4溶液和NaOH固体.取一定量NaOH固体溶于水,随后依次加入(填“HL”或“CuSO4”,下同)、,所得碱性浸出剂的主要成分为甘氨酸铜(CuL2)等.
(3)浸出:将经打磨的铜钢废料投入浸出剂,控制温度50℃,通入空气,并搅拌.浸出剂不与钢作用,但与铜反应,最终铜全部转化为CuL2进入溶液,从而实现铜、钢分离.
①浸出时发生的反应过程为CuL2+Cu+2L-═2、CuL-2.
②其它条件不变时,空气流量对铜浸出速率的影响如图-1所示.当空气流量超过1.0L⋅min-1时,铜浸出速率急剧下降的可能原因是.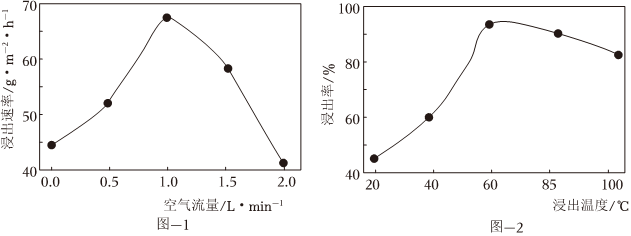
Ⅱ.从铜烟灰(主要成分为Cu(OH)Cl、FeO、Fe2O3、Zn3(PO4)2)中回收铜的主要步骤为:酸浸→萃取→反萃取→电解.已知:Zn3(PO4)2溶于无机酸.
(4)酸浸:将铜烟灰用硫酸浸出,控制其他条件相同,铜浸出率与温度的变化关系如题16图-2所示.随温度升高,铜浸出率先增大后减小的可能原因是.
(5)萃取、反萃取:向浸出液(Cu2+浓度为7g/L)中加入有机萃取剂(RH)萃取,其原理可表示为:Cu2+(水层)+2RH(有机层)⇌R2Cu(有机层)+2H+(水层).向萃取所得有机相中加入硫酸,反萃取得到水相(Cu2+浓度达40g/L).该工艺中设计萃取、反萃取的目的是.组卷:141引用:3难度:0.3 -
17.氢气是一种清洁能源,研发新型制氢技术具有重要意义.
(1)“表面改性铝粉分解水制氢”因Al储量丰富和较强的还原活性得到广泛应用.
铝粉表面的致密氧化膜是影响Al还原活性的主要因素,工业上常用NaOH溶液或锡酸钠(Na2SnO3)溶液作为Al粉的改性试剂.
已知:+3H2O⇌Sn(OH)4+2OH-;Ksp[Sn(OH)4]=1.0×10-56.SnO2-3
①利用NaOH溶液改性Al粉的原理可用化学方程式表示为.
②348K下,向两份质量和粒径均相同的Al粉中,分别加入等体积0.05mol•L-1NaOH溶液和0.025mol•L-1Na2SnO3溶液改性Al粉,氢气产率随时间的变化关系如图-1所示.Na2SnO3溶液改性效果明显优于NaOH溶液的可能原因是.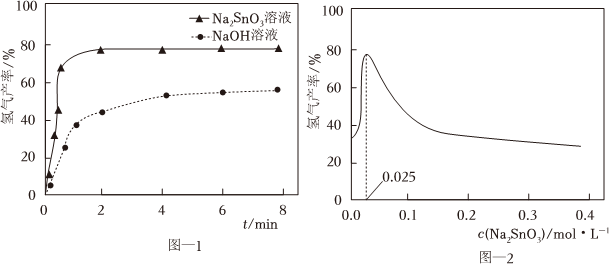
③保持其他条件不变,氢气产率随Na2SnO3溶液浓度的变化关系如图-2所示.当Na2SnO3溶液浓度为0.025mol•L-1时,氢气产率接近80%.但Na2SnO3溶液过大或过小会大大降低氢气产率,其可能原因分别是.
(2)“纳米铷镍合金(RuNi)催化氨硼烷水解制氢”主要经过吸附和还原的过程.
①氨硼烷(NH3BH3)的结构式为(标出配位键).
②室温下,氨硼烷在铷镍合金作用下快速水解生成氢气.根据过渡态理论,氨硼烷在铷镍合金作用下易水解的原因可解释为.
③铷镍合金催化氨硼烷水解的可能反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与B原子相连的3个H原子分别用1H、2H和3H标记).根据元素电负性的变化规律推测题图的虚线框内微粒A和B的化学式分别为;步骤Ⅱ可描述为.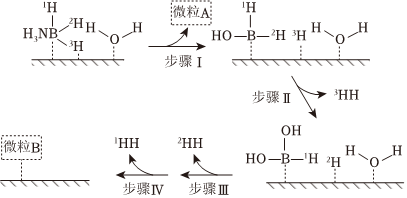 组卷:113引用:1难度:0.1
组卷:113引用:1难度:0.1


