2023-2024学年北京理工大学附中高三(上)月考化学试卷(10月份)
发布:2024/9/14 6:0:10
一、选择题:(每小题只有一个选项符合题意,每小题3分,共42分)
-
1.下列图示的混合物不属于胶体的是( )




A.氯化钠注射液 B.云雾 C.稀豆浆 D.烟水晶 组卷:253引用:5难度:0.8 -
2.下列物质的应用与氧化还原反应无关的是( )
组卷:34引用:5难度:0.8 -
3.下列化学用语或图示表达正确的是( )
组卷:82引用:6难度:0.6 -
4.下列实验室制取气体的方法不合理的是( )
组卷:31引用:2难度:0.8 -
5.下列反应的离子方程式书写正确的是( )
组卷:13引用:1难度:0.6 -
6.某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象.为确定该溶液的组成,还需检验的离子是( )
组卷:639引用:70难度:0.7
二、填空题(共58分)
-
18.我国科学家用粗氢氧化高钴[Co(OH)3]制备硫酸钴晶体(CoSO4•7H2O),其工艺流程如下。
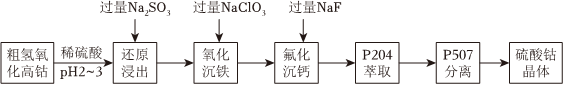
已知:ⅰ.还原浸出液中的阳离子有:Co2+、H+、Fe2+和Ca2+等
ⅱ.部分物质的溶度积常数如下(25℃)
ⅲ.CoSO4•7H2O溶解度随温度升高而明显增大物质 Ksp CaF2 4.0×10-11 Fe(OH)3, 2.8×10-39
(1)氢氧化高钴溶于硫酸的化学方程式是.
(2)浸出Co2+时,理论上氧化性离子和还原性离子物质的量之比为.
(3)写出“氧化沉铁”的离子方程式;
25℃时,浊液中铁离子浓度为mol/L((此时pH为4)。
(4)结合平衡移动原理解释“氟化沉钙”步骤加入过量NaF的原因。
(5)P507萃取后,经反萃取得到硫酸钴溶液,将硫酸钴溶液经操作,得到硫酸钴晶体。
(6)用滴定法测定硫酸钴晶体中的钴含量,其原理和操作如下。
在溶液中,用铁氰化钾将Co(Ⅱ)氧化为Co(Ⅲ),过量的铁氰化钾以Co(Ⅱ)标准液返滴定。反应的方程式为:Co2++[Fe(CN)6]3-═Co3++[Fe(CN)6]4-。
已知:铁氰化钾标准液浓度为cmol/L,Co(Ⅱ)标准液质量浓度为ρg/L。
取mg硫酸钴晶体,加水配成200mL溶液,取20mL待测液进行滴定,消耗V1mL铁氰化钾标准液、V2mLCo(Ⅱ)标准液。
计算样品中钴含量ω=(以钴的质量分数ω计)。组卷:30引用:2难度:0.5 -
19.某实验小组对Na2S2O3分别与FeCl3、Fe2(SO4)3的反应进行实验探究。
实验药品:0.1mol/LNaS2O3溶液(pH=7);0.1mol/LFeCl3溶液(pH=1);
0.05mol/LFe2(SO4)3溶液(pH=1)。
实验过程
资料:ⅰ.Na2S2O3在酸性条件下不稳定,发生自身氧化还原反应;实验编号 Ⅰ Ⅱ Ⅲ 实验操作 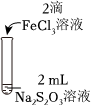
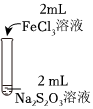
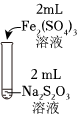
实验现象 溶液呈紫色,静置后紫色迅速褪去,久置后出现淡黄色浑浊 溶液呈紫色,静置后紫色褪去,久置后不出现淡黄色浑浊 溶液呈紫色,静置后紫色缓慢褪去,久置后不出现淡黄色浑浊
ⅱ.Fe3++S2⇌Fe(S2O3)+暗紫色,Fe2+遇S2O2-3无明显现象O2-3
(1)配制FeCl3溶液时,需要用盐酸酸化,结合离子方程式解释原因:。
(2)对实验Ⅰ中现象产生的原因探究如下:
①证明有Fe2+生成:取实验Ⅰ中褪色后溶液,加入1~2滴K3[Fe(CN)6]溶液,观察到。
②实验Ⅰ中紫色褪去时S2被氧化成S4O2-3,相关反应的离子方程式是O2-6。
③实验Ⅰ和Ⅱ对比,Ⅰ中出现淡黄色浑浊,而Ⅱ中不出现淡黄色浑浊的原因是。
(3)为探究实验Ⅱ和Ⅲ中紫色褪去快慢不同的原因,设计实验如下:
①试剂X是实验编号 Ⅳ Ⅴ 实验操作 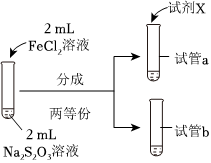
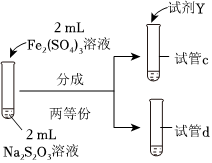
实验现象 紫色褪去时间a>b 紫色褪去时间c>d 。
②由实验Ⅳ和实验Ⅴ得出的结论是。组卷:40引用:1难度:0.5


