2022-2023学年江苏省连云港市东海县高二(上)期中化学试卷
发布:2024/9/28 10:0:1
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
-
1.黑火药是中国古代四大发明之一,其爆炸反应为 2KNO3+S+3C=K2S+N2↑+3CO2↑。下列说法正确的是( )
组卷:327引用:9难度:0.7 -
2.反应NH4Cl+NaNO2═NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是( )
组卷:742引用:39难度:0.7 -
3.阅读下列资料,完成3~5题:氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,其热化学方程式为4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)ΔH=-904kJ•mol-1。
下列氮及其化合物的性质与用途具有对应关系的是( )组卷:5引用:0难度:0.70 -
4.阅读下列资料,完成3~5题:氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,其热化学方程式为4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g) ΔH=-904kJ⋅mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。
对于反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),下列有关说法不正确的是( )组卷:2引用:0难度:0.70 -
5.阅读下列资料,完成3~5题:氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,其热化学方程式为4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g) ΔH=-904kJ•mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。
实验室采用下列装置制取氨气,正确的是( )组卷:21引用:0难度:0.70
二、非选择题:共4题,共61分。
-
16.MnO2是重要的化工原料,由软锰矿(主要成分为MnO2,主要杂质有Al2O3和SiO2)制备MnO2的一种工艺流程如图:
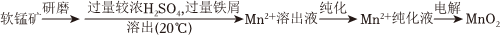
资料:①该工艺条件下MnO2与H2SO4不反应。
②部分金属阳离子沉淀的pH(25℃)。
(1)“溶出”前,软锰矿需要进行研磨的目的Fe3+ Al3+ Mn2+ Fe2+ 开始沉淀时 1.5 3.4 5.8 6.3 完全沉淀时 2.8 4.7 7.8 8.3 。
(2)“溶出”时,Fe的氧化过程及得到Mn2+的主要途径如图所示。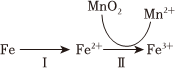
步骤Ⅱ是从软锰矿石中溶出Mn2+的主要反应,反应的离子方程式是。
(3)“纯化”时,先向溶出液中加入MnO2,将Fe2+氧化;再加入NH3•H2O调节溶液pH,使Fe3+、Al3+转化为氢氧化物沉淀而除去。适宜调节的pH范围是。
(4)“纯化”后,过滤所得的滤渣中含有Al(OH)3和Fe(OH)3,实验室欲以该滤渣为原料制备少量Al2O3,实验操作为:取少量滤渣放入烧杯中,。(须使用的试剂:6mol•L-1NaOH溶液、干冰、蒸馏水)
(5)向4.350g所得MnO2产品中依次加入足量6.700gNa2C2O4和足量稀H2SO4,加热至充分反应,再用0.0200mol•L-1KMnO4溶液滴定剩余Na2C2O4至终点,消耗KMnO4溶液的体积为20.00mL。已知过程中发生的反应为:5C2+O2-4+16H+→2Mn2++10CO2↑+8H2O、MnO2+C22MnO-4+4H+→Mn2++2CO2↑+2H2O。O2-4
①滴定终点的现象是:。
②计算该产品中MnO2的纯度(杂质不参加反应,写出计算过程)。组卷:11引用:2难度:0.7 -
17.利用纳米铁粉及生物技术除去废水中的氮是当今环保领域重要的研究课题。
Ⅰ.纳米铁粉可用于去除废水中的硝态氮(以表示),反应原理如图1所示。NO-3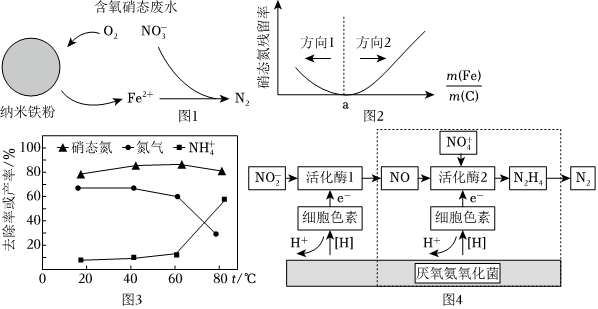
(1)液相还原法制备纳米铁粉:采用硼氢化物如KBH4、NaBH4等与铁离子(Fe2+、Fe3+)混合反应。NaBH4(B为+3价,pH=8.6)溶液还原Fe2+,除生成等物质的量的纳米铁粉和一种气体外,还生成B(OH)3。写出该反应的离子方程式。
(2)有研究发现,在铁粉总量一定的条件下,水中的溶解氧过多不利于硝态氮去除。其原因是。
(3)利用纳米铁粉与活性炭可提升硝态废水中硝态氮的去除效率。控制纳米铁粉与活性炭总质量一定,反应时间相同,测得废水中硝态氮残留率与混合物中的关系如图2所示,m(Fe)m(C)过大和过小都会导致硝态氮残留率上升,但方向1上升幅度小于方向2,硝态氮残留率呈现如此变化的原因是m(Fe)m(C)。
Ⅱ.Fe2+能提高厌氧氨氧化菌生物活性,加快生物转化硝态氮生成氮气的速率。某科研小组利用厌氧氨氧化菌与纳米铁粉相结合的方法去除废水中的硝态氮。
(4)保持其他条件相同,在不同的温度下进行脱硝,测定废水中硝态氮的去除率与含氮产物的产率如图3所示。与60℃相比,80℃时产物产率变化的原因是。
(5)厌氧氨氧化菌将转化为N2的可能机理如图4所示,其中虚线框中物质转化过程可描述为NO-2。组卷:12引用:2难度:0.5


