2022-2023学年湖北省武汉市部分重点高中高二(下)期末化学试卷
发布:2024/8/2 8:0:9
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1.化学与生产、生活和科技密切相关。下列说法正确的是( )
组卷:6引用:1难度:0.6 -
2.湖北省博物馆的镇馆之宝——曾侯乙编钟由青铜所铸。下列说法错误的是( )
组卷:20引用:2难度:0.6 -
3.2021年9月24日,中科院天津工业生物技术研究所成果“无细胞化学酶系统催化CO2合成淀粉”在国际学术期刊《自然》上发表。其中一步核心反应如图所示,设NA为阿伏加德罗常数的值。
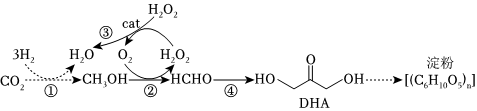
下列说法错误的是( )组卷:17引用:1难度:0.7 -
4.宏观辨识与微观探析是化学学科核心素养之一。下列对应离子方程式书写错误的是( )
组卷:29引用:1难度:0.6 -
5.化学物质与人类生产活动、生命健康密切相关。下列说法错误的是( )
组卷:36引用:1难度:0.5 -
6.由实验操作和现象,可得出相应正确结论的是( )
实验操作 现象 结论 A 向苯的样品加入浓溴水,振荡 未出现白色沉淀 样品中不含苯酚 B 向蔗糖溶液中滴加稀硫酸,水浴加热,加入新制的Cu(OH)2悬浊液 无砖红色沉淀 蔗糖未发生水解 C 在火焰上灼烧搅拌过某无色溶液的玻璃棒 火焰出现黄色 不能确定溶液中含有Na元素 D 向装有电石的圆底烧瓶中缓慢滴加饱和食盐水 产生的气体使酸性高锰酸钾溶液褪色 CaC2与H2O反应生成C2H2 组卷:10引用:1难度:0.5
二、非选择题:本题共4小题,共55分。
-
18.利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如图:
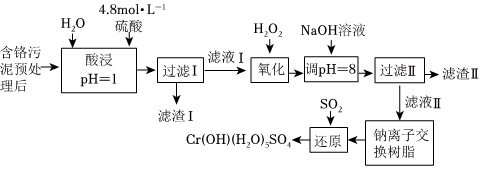
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4mol⋅L-1的浓硫酸配制240mL4.8mol⋅L-1的硫酸,需量取浓硫酸mL。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2,写出此反应的离子方程式O2-7。在相同时间内,测得温度对Cr3+转化率的影响如图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是。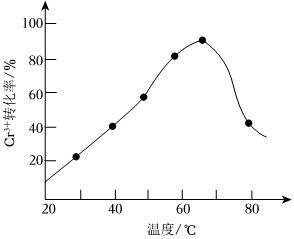
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
①滤渣Ⅱ的主要成分为阳离子 Fe3+ Al3+ Mg2+ Ca2+ 开始沉淀时的pH 1.5 3.4 8.9 11.9 沉淀完全时的pH 2.8 4.7(>8溶解) 10.9 14 。
②用NaOH调节溶液的pH不能超过8,其理由是。
(4)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是。
(5)上述流程中加入NaOH溶液后,Cr2转化为O2-7,请写出“用SO2还原”生成CrOH(H2O)5SO4沉淀的化学方程式CrO2-4。
(6)利用膜电解技术,以Na2CrO4为主要原料制备Na2Cr2O7的工作原理如图所示(a、b电极材料均为石墨);a极与电源的极相连,制备1molNa2Cr2O7时,理论上左侧溶液总质量增重g。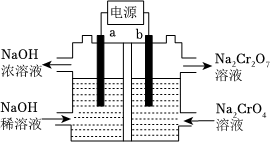 组卷:18引用:1难度:0.6
组卷:18引用:1难度:0.6 -
19.氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。甲烷水蒸气催化重整是制备高纯氢的方法之一。
Ⅰ.一种利用太阳能催化该反应的原理如图1所示,以气体分压(单位为kPa)表示的各步反应的平衡常数(Kp)与温度(T)变化关系如图2所示。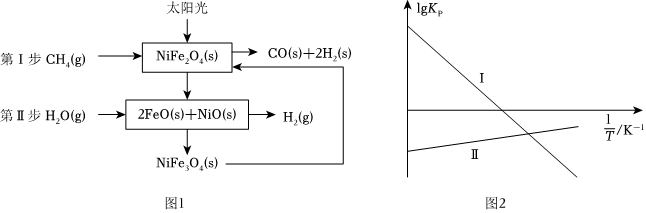
(1)根据图1分析该反应的催化剂为。
(2)甲烷水蒸气重整制氢反应CH4(g)+H2O(g)⇌CO(g)+3H2(g)的ΔS0(填“>”“<”或“=”),该反应在(填“高温”或“低温”)条件下容易自发进行。
Ⅱ.甲烷水汽重整反应是我国主要的制氢技术,有关反应如下:
反应ⅰ:CH1(g)+H2O(g)⇌CO(g)+3H2(g)ΔH1=akJ⋅mol-1;
反应ⅱ:CO(g)+H2O(g)⇌CO2(g)+H2(g)ΔH2=bkJ⋅mol-1。
(3)对于反应ⅰ,下列叙述正确的是(填标号)。
A.恒温、恒容条件下,加入水蒸气,活化分子百分数增大,反应速率增大
B.升高温度,活化分子百分数增大,有效碰撞频率增大,反应速率增大
C.恒温、恒容条件下,加入惰性气体,压强增大,CH4的平衡转化率减小
D.加入合适的催化剂,同时降低反应温度,能实现单位时间内转化率不变
(4)一定温度下,向恒容密闭反应器中通入CH4和H2O(g),起始时CH4和H2O(g)的分压分别为2MPa、3MPa,发生反应ⅰ和反应ⅱ。反应进行t1min时达到平衡状态,此时CO、CO2的分压分别为mMPa、nMPa。
①H2O(g)的平衡分压为MPa(用含m、n的代数式表示,下同)。
②反应ⅱ的Kp=(用平衡时各物质的分压代替物质的量浓度)。
③复合载氧体可以氧化甲烷制取合成气(CO、H2),如图为350℃时载氧体的质量与时间的关系[一定条件下有积碳反应发生,反应ⅲ:2CO(g)⇌2CO2(g)+C(s)或反应ⅳ:CH4(g)⇌C(s)+2H2(g)]。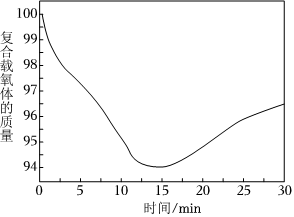
从开始到13min的时候,曲线呈下降趋势的原因主要是甲烷还原载氧体,载氧体失去氧而出现失重的情况;反应在13~15min时,出现了一个短暂的小平台,其主要的原因是。组卷:14引用:1难度:0.5


