2023-2024学年安徽省安庆市桐城市大关中学九年级(上)月考化学试卷(10月份)
发布:2024/9/18 16:0:8
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
-
1.下列生活中现象主要是由化学变化引起的是( )
组卷:37引用:5难度:0.7 -
2.下列做法不利于防治空气污染、保护生态环境的是( )
组卷:8引用:3难度:0.8 -
3.没有化学科学的发展,就没有今日丰富多彩的世界.下列事实与化学没有密切联系的是( )
组卷:98引用:16难度:0.9 -
4.下列实验基本操作正确的是( )
组卷:154引用:6难度:0.7 -
5.下列物质的用途主要由其物理性质决定的是( )
组卷:3引用:1难度:0.8
二、本大题包括5小题,共28分
-
16.某小组同学向盛有MnO2的试管中加入H2O2溶液,发现有大量气泡和水雾生成。小组同学对H2O2分解反应进行了深入的研究。
Ⅰ.探究水雾产生的原因
【进行实验】
分别向三支试管中依次加入0.5g MnO2和30mL溶质质量分数不同的H2O2溶液,用温度传感器测定反应过程中溶液温度的变化,现象如下。
【解释与结论】溶液 5% H2O2溶液 10% H2O2溶液 30% H2O2溶液 温度变化 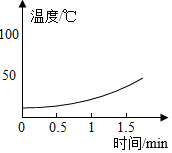
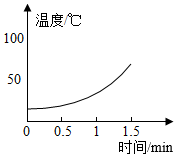
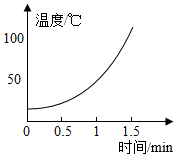
水雾 有少量水雾 有较多水雾 有大量水雾
(1)在MnO2作催化剂的条件下,H2O2发生分解反应的文字表达式为,该反应热量(填“吸收”或“放出”)。
(2)H2O2溶液的溶质质量分数与反应中溶液温度变化的关系是。
(3)根据以上实验,可得出的结论是。
Ⅱ.探究影响H2O2分解反应速率的因素。
【实验方案】
(4)对比实验①②,目的是探究实验编号 H2O2溶液 蒸馏水 催化剂 温度/℃ 溶质质量分数 V/mL V/mL ① 10% 10 20 无催化剂 20 ② 10% 10 20 0.5g MnO2 20 ③ 10% 15 x 0.5g MnO2 20 与H2O2分解反应速率是否有关。
(5)实验②③,目的是探究溶质质量分数与H2O2分解反应速率是否有关,则实验③中x是(填字母序号)。
a.15
b.30
【实验过程及分析】
在恒温恒容的密闭容器中完成以上实验,用压强传感器测量反应过程中容器内的气体压强随时间的变化,实验数据如图所示。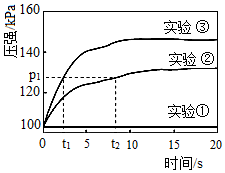
(6)能证明溶质质量分数对H2O2分解反应速率有影响的证据是。组卷:37引用:3难度:0.3 -
17.某兴趣小组的同学分别设计了如图一和图二所示的装置进行空气中氧气含量实验的探究:
【实验1】按图一所示装置,用红磷燃烧的方法测定空气中氧气的体积分数。实验前在100mL集气瓶中加入10mL水。
【实验2】按图二所示装置,利用放大镜聚焦太阳光,提高白磷的温度,用白磷燃烧的方法测定空气中氧气的体积分数。实验前在100mL集气瓶中加入10mL水,注射器中有20mL氮气。
(1)红磷熄灭后,集气瓶冷却至室温,打开止水夹,水能倒吸入集气瓶的原因是。
(2)本实验中,集气瓶底部预先装有少量水的原因是。
(3)按照图二装置进行实验,获得的实验数据记录如表:
(4)根据图二实验过程和数据综合分析,实验开始时,集气瓶内气体体积增大的主要原因是时间/min 0 1 2 3 4 5 6 7 8 9 10 注射器读数/mL 20.0 34.0 40.0 30.0 25.6 18.0 12.5 8.4 4.8 3.0 3.0 。
(5)根据实验数据计算得到,空气中氧气的体积分数为(计算结果精确到0.1%)。组卷:24引用:1难度:0.6


