2022-2023学年福建省厦门一中高二(上)第一次月考化学试卷
发布:2024/9/20 17:0:8
一、单选题
-
1.为了实现“碳达峰”和“碳中和”,太阳能的利用逐渐得到重视。下列说法错误的是( )
组卷:32引用:4难度:0.6 -
2.某同学设计如图所示实验,探究反应中的能量变化。下列判断正确的是( )
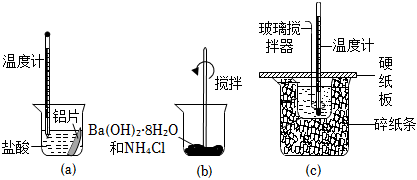 组卷:68引用:10难度:0.7
组卷:68引用:10难度:0.7 -
3.下列事实不能用勒夏特列原理解释的是( )
组卷:7引用:2难度:0.8 -
4.血红蛋白分子(Hb)在人体中存在如下过程:①Hb+O2(g)⇌Hb(O2) K1;②Hb+CO(g)⇌Hb(CO) K2。下列说法错误的是( )
组卷:46引用:4难度:0.8 -
5.将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)⇌2NH3(g)+CO2(g).判断该分解反应已经达到化学平衡的是( )
组卷:596引用:27难度:0.9 -
6.汽车尾气净化中的某反应:NO(g)+CO(g)⇌
N2(g)+CO2(g)△H=-373.4kJ•mol-1在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是( )12组卷:9引用:5难度:0.5
-
18.二甲醚(CH3OCH3)是重要的化工原料,也是一种清洁的能源,可用CO和H2制得,由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g)⇌CH3OH(g)ΔH1═-90.7kJ⋅mol-1K1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)ΔH2═-23.5kJ⋅mol-1K2
③CO(g)+H2O(g)⇌CO2(g)+H2(g)ΔH3═-41.2kJ⋅mol-1K3
(1)反应3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)的ΔH═kJ⋅mol-1;该反应的平衡常数K═(用K1、K2、K3表示)。
(2)下列措施中,能提高①中CH3OH产率的有。
A.使用过量的CO
B.升高温度
C.增大压强
D.使用催化剂
(3)将合成气以=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)⇌CH3OCH3(g)+H2O(g)ΔH,其中CO的平衡转化率随温度、压强的变化关系如图所示,下列说法正确的是n(H2)n(CO)(填字母)。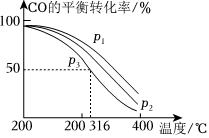
A.ΔH<0
B.p1>p2>p3
C.若在p3和316℃时,起始时=3,则平衡时,α(CO)小于50%n(H2)n(CO)
(4)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME)。观察图,当约为n(Mn)n(Cu)时最有利于二甲醚的合成。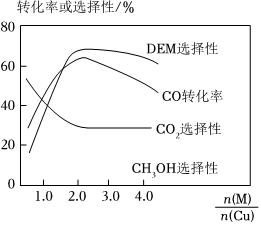
(5)如图为绿色电源“二甲醚燃料电池”的工作原理示意图,a极生成的气体是,b电极的电极反应式为。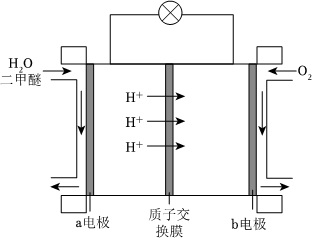
(6)甲醇液相脱水法制二甲醚的原理是:CH3OH+H2SO4→CH3HSO4+H2O,CH3HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是。组卷:8引用:2难度:0.6 -
19.习近平总书记在世界领导人气候峰会上指出,中国将在2030年前实现“碳达峰”、2060年前实现“碳中和”。这是中国基于推动构建人类命运共同体的责任担当和实现可持续发展的内在要求作出的重大战略决策。因此CO2的捕集、创新利用与封存成为科学家研究的重要课题。
(1)最近有科学家提出“绿色自由”构想:先把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,并使之变为可再生燃料甲醇。“绿色自由”构想技术流程如图: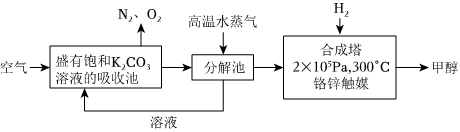
上述工艺中采用气液逆流接触吸收(空气从吸收池底部进入,溶液从顶部喷淋),其目的是。写出吸收池中反应的化学方程式。
(2)CO2和H2合成甲烷也是CO2资源化利用的重要方法。一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图1所示,该反应的化学方程式为,反应过程中碳元素的化合价为-2价的中间体是。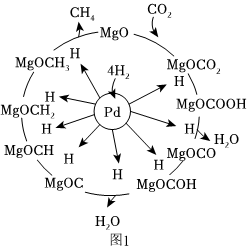
(3)将CO2和CH4作为原料制造合成气的方法如下:200℃时,以镍合金为催化剂,向4L容器中通入4molCO2、4molCH4发生如下反应:CO2(g)+CH4(g)⇌2CO(g)+2H2(g)ΔH═+247kJ/mol。平衡体系中各组分体积分数如下表:
①此温度下该反应的平衡常数K=物质 CH4 CO2 CO H2 体积分数 0.3 0.3 0.2 0.2 。
②为了探究反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol/L,根据相关数据,粗略地绘制出两条速率-浓度关系曲线(如图):v正~c(CH4)和v逆~c(CO)。则与v正~c(CH4)相对应曲线是图中(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度反应重新达到平衡,则此时v正、v逆相应的平衡点分别为(填字母)。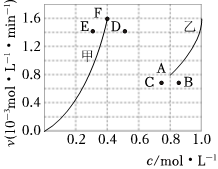 组卷:5引用:2难度:0.5
组卷:5引用:2难度:0.5


