2023-2024学年北京166中高三(上)期中化学试卷
发布:2024/10/2 6:0:2
一、选择题
-
1.下列有关试剂保存和使用的措施不正确的是( )
组卷:33引用:4难度:0.5 -
2.下列与事实对应的化学用语正确的是( )
组卷:47引用:3难度:0.6 -
3.下列反应的离子方程式书写正确的是( )
组卷:29引用:2难度:0.6 -
4.下列说法正确的是( )
组卷:29引用:4难度:0.8 -
5.“神舟十三号”飞船所使用的砷化镓太阳能电池是我国自主研发、自主生产的产品,拥有全部知识产权。砷(As)和镓(Ga)都位于第四周期,分别位于第VA族和第ⅢA族。下列说法不正确的是( )
组卷:199引用:5难度:0.7 -
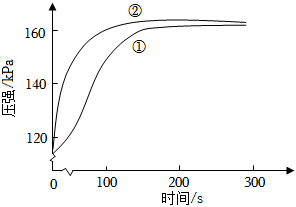 6.在两个密闭的锥形瓶中,0.05g形状相同的镁条(过量)分别与2mL 2mol•L-1的盐酸和醋酸反应,测得容器内压强随时间的变化曲线如图。下列说法正确的是( )组卷:80引用:8难度:0.7
6.在两个密闭的锥形瓶中,0.05g形状相同的镁条(过量)分别与2mL 2mol•L-1的盐酸和醋酸反应,测得容器内压强随时间的变化曲线如图。下列说法正确的是( )组卷:80引用:8难度:0.7
二、
-
18.阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如下图所示:
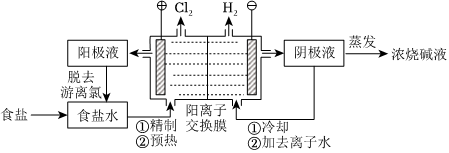
(1)电解饱和食盐水的化学方程式为。
(2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是(填字母序号)。
a.Na2SO4 b.Na2SO3c.热空气吹出 d.降低阳极区液面上方的气压
(3)食盐水中的I-若进入电解槽,可被电解产生的Cl2氧化为ICl,并进一步转化为.IO-3可继续被氧化为高碘酸根(IO-3),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。IO-4
①从原子结构的角度解释ICl中碘元素的化合价为+1价的原因:。
②NaIO3被氧化为NaIO4的化学方程式为。
(4)在酸性条件下加入NaClO溶液,可将食盐水中的I-转化为I2,再进一步除去。通过测定体系的吸光度,可以检测不同pH下I2的生成量随时间的变化,如图所示。已知:吸光度越高表明该体系中c(I2)越大。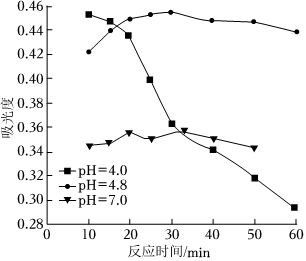
①结合化学用语解释10 min时不同pH体系吸光度不同的原因:。
②pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因:。
③研究表明食盐水中I-含量≤0.2 mg•L-1时对离子交换膜影响可忽略。现将1m3含I-浓度为1.47 mg•L-1 的食盐水进行处理,为达到使用标准,理论上至少需要0.05mol•L-1 NaClO溶液L.(已知NaClO的反应产物为NaCl,溶液体积变化忽略不计)组卷:105引用:5难度:0.6 -
19.MnSO4是一种重要的化工产品。以菱锰矿(主要成分为MnCO3,还含有Fe3O4、FeO、CoO等)为原料制备MnSO4的工艺流程如图1。
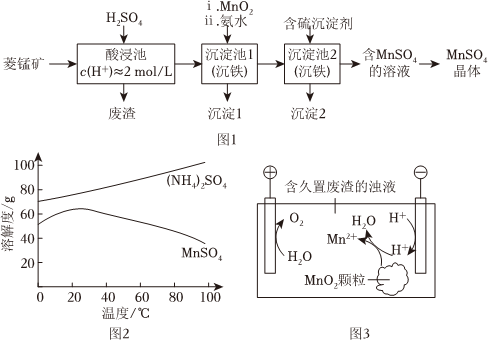
资料:金属离子沉淀的pH
(1)酸浸后所得溶液的金属阳离子包括Mn2+、Co2+、金属离子 Fe3+ Fe2+ Co2+ Mn2+ 开始沉淀 1.5 6.3 7.4 7.6 完全沉淀 2.8 8.3 9.4 10.2 。
(2)沉淀池1中,先加MnO2充分反应后再加氨水。写出加MnO2时发生反应的离子方程式:。
(3)沉淀池2中,不能用NaOH代替含硫沉淀剂,原因是。
(4)如图2为MnSO4和(NH4)2SO4的溶解度曲线。从“含MnSO4的溶液”中提取“MnSO4晶体”的操作为,洗涤干燥。
(5)受实际条件限制,“酸浸池”所得的废渣中还含有锰元素,其含量测定方法如下。
ⅰ.称取ag废渣,加酸将锰元素全部溶出成Mn2+,过滤,将滤液定容于100mL容量瓶中;
ⅱ.取25.00mL溶液于锥形瓶中,加入少量催化剂和过量(NH4)2S2O8溶液,加热、充分反应后,煮沸溶液使过量的(NH4)2S2O8分解。
ⅲ.加入指示剂,用bmol/L(NH4)2Fe(SO4)2溶液滴定。滴定至终点时消耗(NH4)2Fe(SO4)2溶液的体积为cmL,重新变成Mn2+。MnO-4
①补全步骤ⅱ中反应的离子方程式:2Mn2++S2+O2-8催化剂△+MnO-4+。
②废渣中锰元素的质量分数为。
(6)废渣长期露置于空气;其中的锰元素逐渐转化为MnO2。研究者用图3装置提取MnO2中的锰元素。图3中“H•”代表氢自由基。实验测得电解时间相同时,随外加电流的增大,溶液中的c(Mn2+)先增大后减小,减小的原因可能是、。(写出两条)组卷:83引用:9难度:0.5


