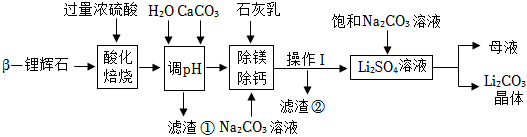
24.阅读下面科普短文。
我们的胃液呈酸性,是因为胃腺壁细胞能分泌出盐酸。胃酸在人体的消化吸收中发挥着重要作用,比如为胃蛋白酶提供适宜的酸性环境,分解食物中的结缔组织和肌纤维。使其易于被消化吸收。
你知道吗?深受人们喜爱的早餐食品燕麦中常添加颗粒极小的铁粉,它既可以作为双吸剂(起到干燥和减缓食品变质的作用),还可以作为补铁剂。要把铁粉变为人体需要的、能吸收的营养元素,就离不开胃酸的帮助。
健康人胃液的pH在0.9~1.5,胃液的pH不仅影响人的消化吸收功能,还对伴随食物进入人胃内的各类病菌的繁殖有影响。某医院对99位胃溃疡和十二指肠溃疡等患者胃液的pH及胃液中病菌进行了检测,结果如下表所示。
表——人体胃液pH情况分析
| 分组 |
胃液的pH |
受检患者人数 |
胃液中检出病菌的人数及比例 |
| A |
≤2.0 |
7 |
0(0.0%) |
| B |
2.0-4.0 |
13 |
3(23.1%) |
| C |
4.0-6.0 |
26 |
17(65.4%) |
| D |
>6.0 |
53 |
45(84.9%) |
胃酸过多会对胃黏膜产生侵蚀作用,并使人感觉反酸或胃灼热。治疗胃酸过多的药主要有两大类:一是抑酸药,能抑制胃酸分泌,但本身不能和胃酸反应;二是抗酸药,能直接与胃酸反应。常服用的抗酸药的药物有碳酸氢钠、氢氧化铝、氧化镁、氢氧化镁和碳酸钙等。
胃溃疡患者若服用不合适的抗酸药,会因胃内气体压力增大而引起胃穿孔。患者如长期使用抗酸药,很可能刺激胃酸分泌过多。因此,应遵医嘱合理使用抗酸类和抑酸类药物。
(一)依据文章内容回答下列问题。
(1)碳酸氢钠、氢氧化铝、氧化镁、氢氯化镁和碳酸钙,属于氧化物的是
(填化学式)。
(2)铁粉可以减缓食物变质,是因为铁可以和空气中的
反应。
(3)燕麦中的铁粉遇到胃酸发生的化学反应,化学方程式是
。
(4)分析表格数据,可以得出胃液pH越
(填“大”或“小”)越有利于病菌生存。
(5)下列说法正确的是
(填字母序号)。
A.治疗胃酸过多的药物都能与盐酸反应
B.部分燕麦片中含有极少量的铁单质
C.氢氧化铝、氢氧化镁可以治疗各种胃酸过多
D.选用碳酸钙治疗胃酸过多,同时还可以补钙
(二)胃酸过多会引起不适,不同病症需要服用不同的抗酸药。实验小组同学对抗酸药选择进行探究。
【查阅资料】
1.抗酸药主要利用有效成分与胃液中的过量盐酸反应,药品用量一般为1~2片(约=0.5g~1g)。
2.氧化镁和氧化铁均属于金属氧化物,与盐酸反应的原理相似。
3.胃蛋白酶是胃中唯一的消化性蛋白酶,当pH为3~5时活性较好,当pH超过6时,因变性而失去活性。
4.理想抗酸药应具备起效快速,避免产生气体刺激溃疡面等特点。
【进行实验】
Ⅰ.是否引起胃内压强的变化
锥形瓶中模拟胃酸过多的环境。将气球中的抗酸药加入锥形瓶中。
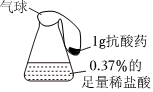 |
1-1 |
氢氧化铝片 |
气球无明显变化 |
| 1-2 |
碳酸氢钠片 |
气球明显膨胀 |
| 1-3 |
铝碳酸镁咀嚼片 |
气球无明显变化 |
| 1-4 |
氧化镁粉末 |
气球无明显变化 |
Ⅱ.是否引起胃内温度和pH的变化
利用图1进行实验。向4个烧瓶中分别加入抗酸药,打开恒压滴液漏斗,滴加0.37%的足量稀盐酸。传感器测得的相关结果见图2、3、4。
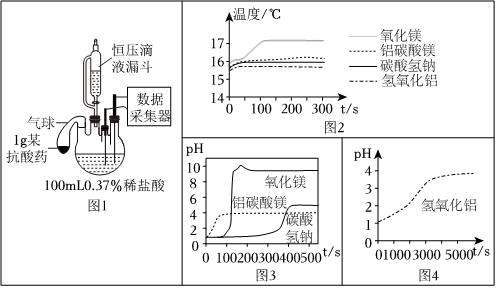
(6)碳酸氢钠的俗称是
。
【解释与结论】
(7)Ⅰ中,实验1-1发生反应的化学方程式为
。
(8)药品用量在1~2片内,针对“严重胃溃疡患者”不建议选用的抗酸药及理由是
。
(9)下列关于氧化镁粉末、氢氧化铝片分别与盐酸反应的叙述正确的是
(填序号)。
A.氧化镁粉末的反应会引起温度上升
B.反应后溶液均显碱性
C.氢氧化铝片的反应更快
D.均有水生成
(10)由上述实验可知,铝碳酸镁咀嚼片的优势有
。
【反思与评价】
(11)查阅资料发现Ⅰ中实验1-3无明显现象是与物质的用量有关。小明同学设计实验证明了铝碳酸镁咀嚼片中含有碳酸根离子,实验操作和现象:取6片铝碳酸镁咀嚼片于试管中,
。