2022-2023学年浙江省杭州市八校联盟高二(上)期中化学试卷
发布:2024/9/7 1:0:8
一、选择题1(本大题共15小题,每个小题列出的四个备选项中,只有一个是符合题目要求的,不选、多选、错选均不得分,每小题2分,共30分)
-
1.下列物质中属于强电解质的是( )
组卷:46引用:4难度:0.9 -
 2.用0.1026mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( )组卷:409引用:18难度:0.9
2.用0.1026mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( )组卷:409引用:18难度:0.9 -
3.下列反应属于吸热反应的是( )
组卷:47引用:4难度:0.8 -
4.下列物质的水溶液因水解而显碱性的是( )
组卷:71引用:3难度:0.3 -
5.下列说法正确的是( )
组卷:6引用:1难度:0.8 -
6.在2A+B⇌3C+4D反应中,表示该反应速率最快的是( )
组卷:234引用:82难度:0.7 -
7.下列电离方程式中正确的是( )
组卷:224引用:9难度:0.9 -
8.某温度时,浓度都是1mol•L-1的两种气体X2和Y2,在密闭容器中发生可逆反应生成气体Z,充分反应后X2的浓度为0.4mol•L-1,Y2的浓度为0.6mol•L-1,生成的Z的浓度为0.4mol•L-1,则该反应的化学方程式(Z用X、Y表示)是( )
组卷:24引用:2难度:0.7 -
9.50℃时水的离子积Kw=3.0×10-14,则在50℃时,c(OH-)=1×10-7mol•L-1的溶液( )
组卷:10引用:1难度:0.8 -
10.下列关于常温下的电解质溶液的说法正确的是( )
组卷:27引用:2难度:0.5
二、非选择题(本大题共5小题,共40分)
-
29.某学生用0.1000mol/LKOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
①移取25.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
②用标准溶液润洗滴定管2~3次
③把盛有标准溶液的滴定管固定好,调节液面使滴定管尖嘴充满溶液
④取标准KOH溶液注入至0刻度以上2~3cm
⑤调节液面至0或0刻度以下,记下读数
⑥把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
(1)正确操作的顺序是(用序号填写)。
(2)步骤④中的滴定管是:(填“酸式滴定管”或“碱式滴定管”)。
(3)当步骤⑥待测液由色变为色,且半分钟内不变化即达到终点,KOH 溶液开始时读数及恰好反应时的读数见表。
请计算待测的盐酸的物质的量浓度实验编号 待测盐酸溶液体积(ml) 滴定开始读数(ml) 滴定结束读数(ml) ① 25.00 0.00 19.95 ② 25.00 1.10 18.30 ③ 25.00 0.20 20.25 mol/l(小数点后面保留4位数字)。
(4)由于操作失误,使得上述所测盐酸溶液的浓度偏高的是。
A.滴定达到终点时,俯视滴定管内液面读数
B.碱式滴定管用蒸馏水洗净后立即取用氢氧化钾溶液进行滴定
C.锥形瓶用蒸馏水洗净后未干燥就装入盐酸待测液
D.滴定时碱式滴定管中氢氧化钾溶液洒落在锥形瓶外组卷:14引用:6难度:0.6 -
30.在2020年中央经济工作会议上,我国明确提出“碳达峰”与“碳中和”目标,因此利用煤炭或CO2合成其它高价值化学品的工业生产显得更加重要。
(1)工业上以煤和水为原料通过一系列转化可获得清洁能源氢气。
已知:①C(s)+O2(g)═CO2(g)△H1=-393.5kJ⋅mol-1
②2H2(g)+O2(g)═2H2O(1)△H2=-571kJ⋅mol-1
③H2O(l)═H2O(g)△H3=+41kJ⋅mol-1
则碳与水蒸气反应C(s)+2H2O(g)CO2+2H2(g)的△H=高温。
(2)工业.上也可以仅利用上述反应得到的CO2和H2进一步合成甲醇:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H<0
①在某恒温恒容密闭容器中充入1mol CO2和3mol H2发生反应,测得CO2和CH3OH(g)浓度随时间变化如下图1所示。则平衡时H2(g)的转化率为,该温度下的平衡常数为L2/mol2。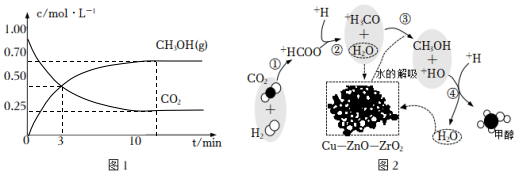
②该反应在催化剂Cu-ZnO-ZrO2表面进行,主反应历程如图2所示(催化剂表面吸附的物种用•标注),下列说法不正确的是。
A.该反应的原子利用率为100%
B.催化剂可以降低反应活化能
C.反应②中,断裂和形成的共价键至少有2种
D.使用催化剂可以提高反应的转化率
(3)将合成的甲醇进行水蒸气重整是电动汽车氢氧燃料电池理想的氢源。该制氢(SRM)系统简单,产物中H2含量高、CO含量低(CO会损坏燃料电池的交换膜),反应如下:
反应Ⅰ(主):CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g)△H1>0
反应Ⅱ(副):H2(g)+CO2(g)⇌CO(g)+H2O(g)△H2>0
温度高于300℃会同时发生反应Ⅲ:CH3OH(g)⇌CO(g)+2H2(g)
①反应1能够自发进行的原因是。
②升温有利于提高CH3OH转化率,但也存在一个明显的缺点是。
③写出一条能提高CH3OH转化率而降低CO生成率的措施。组卷:13引用:3难度:0.4


