2022-2023学年黑龙江省大庆实验中学实验二部高一(下)期末化学试卷
发布:2024/8/17 1:0:3
一、选择题(本大题共14小题)
-
1.化学与社会生产、生活、环境等密切相关,下列说法不正确的是( )
组卷:20引用:4难度:0.7 -
2.下列有关化学用语表示正确的是( )
组卷:12引用:1难度:0.7 -
3.工业上制备下列物质的生产流程合理的是( )
组卷:70引用:8难度:0.8 -
4.NA为阿伏加德罗常数的值。下列叙述正确的是( )
组卷:47引用:2难度:0.5 -
5.下列有关有机物结构、性质的分析正确的是( )
组卷:14引用:2难度:0.5 -
6.下列反应的离子方程式正确的是( )
组卷:58引用:2难度:0.5
二、非选择题
-
17.某学习小组按如图实验流程探究海带中碘含量的测定和碘的提取。
Ⅰ.碘含量的测定
(1)灼烧海带实验用到的主要的含硅酸盐的仪器有酒精灯、玻璃棒、、等。
(2)仪器A的名称为:。
(3)碘浓度还可用色度计测定吸光度,吸光度越大碘浓度越大。用色度计测得某碘溶液的吸光度后,利用以溶液吸光度为纵坐标、碘浓度(μg⋅mL-1)为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取0.10g碘单质,用100mL容量瓶配成碘的CCl4溶液,再从中取出0.10mL加入3.90mLCCl4中配得第一份4.00mL碘的CCl4标准溶液。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是μg⋅mL-1。(注:1μg=1×10-6g)
(4)课题组在其他实验条件相同情况下,研究了不同灰化时间(干海带灼烧成灰的时间)对碘提取效果的影响。其结果如图所示。灰化时间超过40min,测得碘的含量逐渐降低,原因是。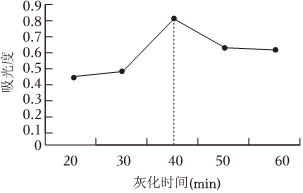
Ⅱ.碘的提取
某同学另取海带原液设计如图实验方案提取碘: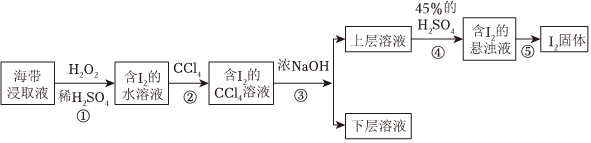
步骤③的离子反应方程式为3I2+6OH-=+5I-+3H2OIO-3
(5)步骤①中发生反应的离子方程式为。
(6)向含有I2的水溶液中加入CCl4振荡静置后的实验现象为。
(7)步骤④发生反应的离子方程式为。组卷:6引用:1难度:0.7 -
18.CO2催化加氢制甲醇(CH3OH)是实现碳达峰、碳中和的途径之一,其反应可表示为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH。
(1)该反应分两步进行,反应过程能量变化如图所示,所有物质均为气态。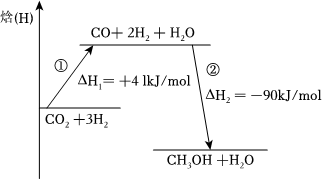
总反应ΔH=。第①步反应的热化学方程式为。
(2)用CO2和H2合成甲醇有利于减少碳排放,其反应原理为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。向甲、乙两个体积都为2.0L的恒容密闭容器中均充入1molCO2和3molH2的混合气体,分别在T1、T2温度下进行反应并达到平衡,反应过程中甲、乙两容器中n(CH3OH)随时间的变化情况如下表:
①两容器的温度T1t/min 0 3 6 12 24 36 甲容器(T1)/mol 0 0.36 0.60 0.80 0.80 0.80 乙容器(T2)/mol 0 0.34 0.55 0.70 0.83 0.83 T2。
②甲容器中,0~6min内用H2表示的平均反应速率为。
③甲容器(T1)中反应达平衡时容器内气体压强与起始时容器内气体压强之比为。
④一定温度下,在一体积固定的密闭容器中投入一定量的CO2和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是。
A.反应中CO2与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1molCO2,同时生成1molCH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
(3)捕碳CO2技术在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)=(NH4)2CO3(aq)ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)=NH4HCO3(aq)ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq)ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是:ΔH3=。
(4)甲醇燃料电池具有很多优点。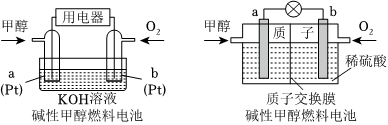
①碱性甲醇燃料电池中,电极a上发生的电极反应式为。
②酸性甲醇燃料电池中,电极b上发生的电极反应式为。组卷:18引用:1难度:0.5


