2023-2024学年江苏省苏州市常熟市高二(上)开学化学试卷
发布:2024/8/23 10:0:9
一、单项选择题:共14题,每小题3分,共42分。每小题只有一个选项最符合题意。
-
1.从天然有机物中可以获取工业生产所需的多种原料。下列说法不正确的是( )
组卷:26引用:1难度:0.9 -
2.下列有关化学用语表示正确的是( )
组卷:12引用:1难度:0.7 -
3.下列说法正确的是( )
组卷:34引用:1难度:0.7 -
4.下列物质性质与用途具有对应关系的是( )
组卷:2引用:1难度:0.5 -
5.阅读下列材料,完成5~7题。
氮是生命的基础,氮及其化合物在生产、生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理。
实验室用如图装置制取氨气并验证氨气的某些化学性质,能达到实验目的的是( )组卷:13引用:0难度:0.70
二、非选择题:共4题,共58分。
-
18.用工业废渣(主要含有Fe2O3、FeO、Al2O3及少量Fe)制备绿矾FeSO4•7H2O晶体得流程如图所示:

(1)“浸泡”过程中加入过量NaOH溶液的目的是。
(2)“溶解”后所得溶液中含有的阳离子为Fe3+和。
(3)“还原”过程中加入FeS2时发生的离子方程式为。
(4)测定绿矾中Fe2+的氧化率实验方案如下:
步骤一:称取一定质量的绿矾样品,将其溶于适量的无氧蒸馏水并配成250mL溶液;
步骤二:取步骤一中配得的溶液25.00mL于锥形瓶,并加入适量稀硫酸酸化,逐滴滴加0.0400mol•L-1KMnO4溶液至恰好完全反应,反应原理为:+Fe2++H+→Mn2++Fe3++H2O(未配平),消耗KMnO4溶液20.00mL;MnO-4
步骤三:另取步骤一中配得的溶液25.00mL于烧杯,加入足量氨水,将沉淀过滤、洗涤、干燥,在空气中灼烧至固体质量不再变化,称得残留红棕色固体的质量为0.4000g。(已知:Fe2+的氧化率=×100%)被氧化的Fe2+质量原物质Fe2+的总质量
根据以上数据,计算该绿矾样品中Fe2+的氧化率(必须有计算过程)。组卷:5引用:1难度:0.6 -
19.采用科学技术减少氮氧化物、SO2等物质的排放,可促进社会主义生态文明建设。
(1)氨法脱硫,是一种高效低耗能的湿法脱硫方式,利用氨水吸收废气中的SO2,并在富氧条件下氧化为硫酸铵,得到化肥产品。该总反应的化学方程式:。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示: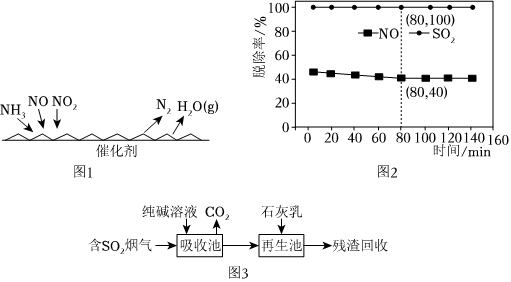
①SCR技术中的氧化剂为。
②当NO2与NO的物质的量之比为1:1时,与足量氨气在一定条件下发生反应。该反应的化学方程式为。
(3)煤燃烧排放的烟气含有SO2和NOx,是大气的重要污染源之一。用Ca(ClO)2溶液对烟气[n(SO2):n(NO)=3:2]同时脱硫脱硝(分别生成、SO2-4),得到NO、SO2脱除率如图2所示:NO-3
①SO2脱除率高于NO的原因可能是:。
②依据图中信息,在80min时,吸收液中n():n(Cl-)=NO-3。
(4)SO2烟气脱除的一种工业流程如图3所示:
①用纯碱溶液吸收SO2将其转化为,反应的离子方程式:HSO-3
②烟气的SO2用石灰乳吸收得到CaSO3浆料,以CaSO3浆料制备NaHSO3溶液的实验方案为。
已知:2CaSO3+Na2SO4+H2SO4+4H2O═2CaSO4•2H2O+2NaHSO3;CaSO4•2H2O;难溶于水;pH=4~6溶液中能大量存在。HSO-3
实验中可选用的试剂:3mol•L-1Na2SO4、3mol•L-1H2SO4、1mol•L-1NaOH。组卷:48引用:1难度:0.7


