2023-2024学年河北省石家庄市新乐一中高三(上)第一次月考化学试卷
发布:2024/9/7 0:0:8
一、单选题(每题3分,共40分)
-
1.化学与生活息息相关,下列相关说法错误的是( )
组卷:14引用:1难度:0.5 -
2.在反应KClO3+6HCl
KCl+3Cl2↑+3H2O中,氧化产物与还原产物的质量之比为( )△组卷:42引用:2难度:0.5 -
3.甲硫醇(CH3SH)是合成蛋氨酸的重要原料。反应CH3OH+H2S
CH3SH+H2O可用于甲硫醇的制备。下列有关说法错误的是( )Al2O3400℃组卷:6引用:1难度:0.8 -
4.化学科学在“国之重器”的打造中发挥着重要作用。下列有关叙述正确的是( )
组卷:18引用:2难度:0.7 -
5.根据如表实验操作和现象所得到的结论正确的是( )
选项 操作和现象 结论 A 向Na2CO3溶液中滴加浓盐酸,反应产生的气体直接通入Na2SiO3溶液中,溶液变浑浊 非金属C>Si B 向20%蔗糖溶液中加入少量稀硫酸,加热,再加入银氨溶液,未出现银镜 蔗糖未水解 C 将石蜡油蒸气通过炽热的碎瓷片分解,得到的气体通入酸性KMnO4溶液,溶液褪色 分解产物中含乙烯 D 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色 Fe3+的氧化性比I2强 组卷:32引用:2难度:0.5 -
6.三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是( )
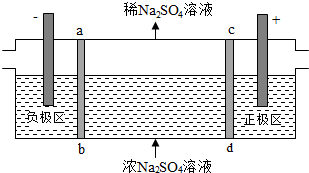 组卷:4105引用:66难度:0.7
组卷:4105引用:66难度:0.7 -
7.利用如图装置进行铁上电镀铜的实验探究。
下列说法不正确的是( )装置示意图 序号 电解质溶液 实验现象 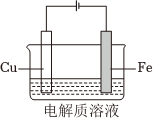
① 0.1mol/LCuSO4+少量H2SO4 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有Fe2+ ② 0.1mol/LCuSO4+过量氨水 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无Fe元素 组卷:352引用:8难度:0.5
二、非选择题
-
22.磷及其化合物在工农业生产中具有重要用途。回答下列问题:
(1)如图所示为提纯白磷样品(含惰性杂质)的工艺流程图。过程Ⅰ中,氧化产物与还原产物的物质的量之比为,过程Ⅲ的化学方程式为。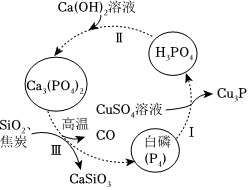
(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]具有能量密度高,循环寿命长,稳定安全等优点,是一种十分具有商业潜力的电极材料,我国科学家研发的一种制备流程如图所示: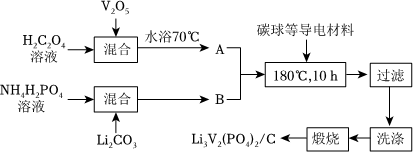
①向复合材料中加入碳单质的作用是。
②A的主要成分为V2(C2O4)3,合成A反应的化学方程式为。
③已知常温下,Li2CO3微溶于水,LiHCO3可溶于水。工业级Li2CO3中含有少量难溶于水且与CO2不反应的杂质。补全下列实验方案:将工业级Li2CO3与水混合,,得到LiHCO3溶液,控温加热使LiHCO3分解形成Li2CO3沉淀,过滤、洗涤、干燥得到Li2CO3纯品。
④锂离子电池是一种二次电池。若用LixC6和Li3V2(PO4)3/C作电极,放电时的电池总反应LixC6+Li3-xV2(PO4)═Li3V2(PO4)3+C6,则电池放电时正极的电极反应式为。组卷:19引用:3难度:0.3 -
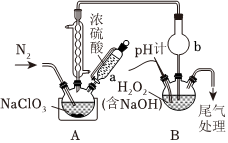 23.实验室模拟NaClO3在浓硫酸环境下制备HClO4,同时将副产物ClO2转化为亚氯酸钠(NaClO2),装置如图所示(夹持装置略)。
23.实验室模拟NaClO3在浓硫酸环境下制备HClO4,同时将副产物ClO2转化为亚氯酸钠(NaClO2),装置如图所示(夹持装置略)。
已知:
①ClO2为黄绿色有毒气体,易溶于水,浓度过高时易发生爆炸;
②HClO4沸点为90℃,遇有机物易爆炸;
③NaClO2碱性环境下稳定,酸性环境见光易分解产生ClO2逸出。
回答下列问题:
(1)实验装置中a的名称为:,b的作用。
(2)检查装置气密性后,加入药品。向装置内通入N2,打开冷凝水,通过a滴入足量浓硫酸,控温50-60℃半小时,停止加热并继续通N2一段时间,将A中反应后混合物冷却,砂芯漏斗过滤除去NaHSO4得HClO4粗产品。A中发生反应的化学方程式为;过滤时不宜选择普通漏斗的原因是;B中发生反应的离子方程式为;若实验中发现pH传感器示数迅速下降,最好采取的措施;实验中持续通入N2的作用除了将ClO2排入装置B中外,还有。
(3)取mgNaClO2粗产品溶于烧杯,分别加入足量碘化钾和稀硫酸,置于暗处反应10分钟,转移并稀释至100mL。取20mL稀释液加入淀粉溶液,用bmol⋅L-1Na2S2O3平行测定三次(已知I2+2S2=2I-+S4O2-3),耗用标准液平均体积为VmL,则粗产品中NaClO2的(摩尔质量为Mg⋅mol-1)质量分数为O2-6%(用含m、b、M和V的代数式表示);若加入碘化钾和稀硫酸后未及时置于暗处,会导致测定结果(填“偏大”“偏小”或“不变”)。组卷:20引用:3难度:0.4


