2023-2024学年浙江省杭州市四校联考高二(上)月考化学试卷(10月份)
发布:2024/9/13 7:0:8
一、选择题(本大题共16小题,每小题3分,共48分。每小题列出的四个备选项中只有一个符合题目要求的,不选、多选、错选均不得分)
-
1.中华民族的发明创造为人类文明进步做出了巨大贡献,下列过程主要是利用化学反应中能量变化的是( )
A B C D 
神十一载人飞船发射
粮食酿醋
湿法炼铜
打磨磁石制司南组卷:4引用:6难度:0.8 -
2.下列事实不能用化学平衡移动原理解释的是( )
组卷:23引用:1难度:0.6 -
3.根据Ca(OH)2/CaO体系的能量循环图,下列说法正确的是( )
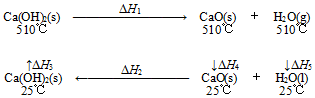 组卷:101引用:13难度:0.5
组卷:101引用:13难度:0.5 -
4.下列有关热化学方程式的叙述正确的是( )
组卷:15引用:1难度:0.7 -
5.下列实验现象或图像信息能充分说明相应的化学反应是放热反应的是( )
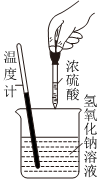
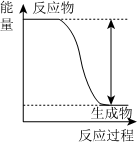
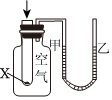
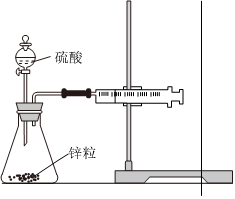
A.温度计的水银柱不断上升 B.反应物总能量大于生成物总能量 C.往试管中加水后,甲处液面低于乙处液面 D.反应开始后,针筒活塞向右移动 组卷:25引用:2难度:0.7 -
6.已知:2CH3CH2CH2CH3(g)+13O2(g)→8CO2(g)+10H2O(l);ΔH=-5758kJ/mol
2(CH3)2CHCH3(g)+13O2(g)→8CO2(g)+10H2O(l);ΔH=-5738kJ/mol
下列说法正确的是( )组卷:11引用:1难度:0.7 -
7.下列有关中和热实验的说法正确的是( )
组卷:160引用:7难度:0.7
二、填空题(本大题共4题,共52分。)
-
20.二氧化碳的转化和利用成为实现“碳达峰”、“碳中和”的重要研究课题二氧化碳加氢制甲醇涉及的反应可表示为:
①CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH1
②CO(g)+2H2(g)⇌CH3OH(g)ΔH2=-90kJ•mol-1
③CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH3=-49kJ•mol-1
(1)根据上述反应求:④CO(g)+H2O(g)⇌CO2(g)+H2(g)ΔH4=。
(2)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上反应④的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。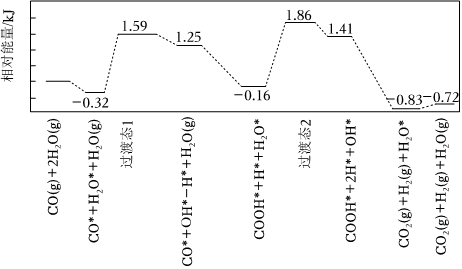
写出该历程中决速步骤的化学方程式:。
(3)在一体积可变的密闭容器中,在保持aMPa下,按照=3投料,平衡时,CO和CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如图所示:n(H2)n(CO2)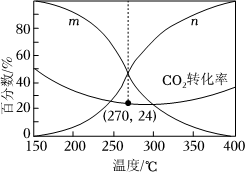
①图中m曲线代表的物质为。
②下列说法正确的是(填标号)。
A.180~380℃范围内,H2的平衡转化率始终低于CO2
B.温度越高,越有利于工业生产CH3OH
C.一定时间内反应,加入选择性高的催化剂,可提高CH3OH的产率
D.150~400℃范围内,随着温度的升高,CO2的反应速率先减小后增大
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,270℃时反应①的分压平衡常数为(保留2位有效数字)。
(4)为了提高甲醇的选择性,CH3OH的选择性是指转化的CO2中生成CH3OH的百分比,某科研团队研制了一种具有反应和分离双功能的分子筛膜催化反应器,原理如图所示。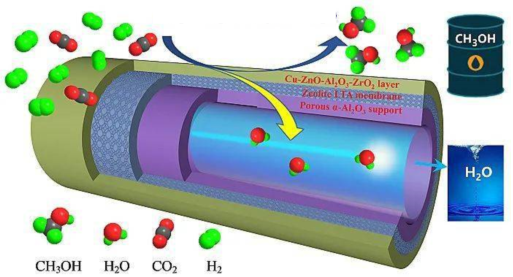
保持压强为3MPa,温度为260℃,向密闭容器中按投料比=3投入一定量CO2和H2,不同反应模式下CO2的平衡化率和CH3OH的选择性的相关实验数据如下表所示。n(H2)n(CO2)
由表中数据可知,在分子筛膜催化反应器模式下,CO2的转化率明显提高,结合具体反应分析可能的原因是实验 反应模式 CO2的平衡转化率 CH3OH的选择性 ① 普通催化反应器 21.9 67.3 ② 分子筛膜催化反应器 36.1 100.0 。组卷:32引用:1难度:0.5 -
 21.乙酸乙酯一般通过乙酸和乙醇酯化合成:
21.乙酸乙酯一般通过乙酸和乙醇酯化合成:
CH3COOH(l)+C2H5OH(l)CH3COOC2H5(l)+H2O(l)浓H2SO4
(1)一定温度下该反应的平衡常数K=4.00。若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸的平衡转化率α=(保留3个有效数字)
(2)若乙酸和乙醇的物质的量之比为n:1,相应平衡体系中乙酸乙酯的物质的量分数为x,请在如图中绘制x随n变化的示意图(计算时不计副反应)。组卷:11引用:1难度:0.5


