2021-2022学年甘肃省陇南市徽县一中高二(上)月考化学试卷(11月份)
发布:2024/5/20 8:0:9
一、单选题(每题3分)
-
1.下列表达不正确的是( )
组卷:37引用:5难度:0.6 -
2.下列依据热化学方程式得出的结论正确的是( )
组卷:203引用:13难度:0.9 -
3.已知H2(g)+Br2(l)=2HBr(g)△H=-72KJ/mol 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如表:
则表中a为( )H2(g) Br2(g) HBr(g) 1mol分子中的化学键断裂时需要吸收的能量/KJ 436 200 a 组卷:13引用:3难度:0.9 -
4.下列反应既是氧化还原反应,又是吸热反应的是( )
组卷:213引用:25难度:0.8 -
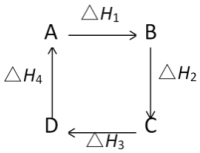 5.物质A在一定条件下可发生一系列转化,由图判断下列错误的是( )组卷:24引用:3难度:0.8
5.物质A在一定条件下可发生一系列转化,由图判断下列错误的是( )组卷:24引用:3难度:0.8 -
6.反应A(g)+3B(g)⇌2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
组卷:93引用:27难度:0.9 -
7.一定温度下,在某恒容的密闭容器中,建立化学平衡:C(s)+H2O(g)⇌CO(g)+H2(g)。下列叙述中不能说明该反应已达到化学平衡状态的是( )
组卷:10引用:7难度:0.7
二、填空题
-
20.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:N2(g)+3H2(g)≒2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。平衡时H2的转化率为%。
(2)平衡后,若提高H2的转化率,可以采取的措施有。
A.加了催化剂
B.增大容器体积
C.降低反应体系的温度
D.加入一定量N2
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)⇌2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:T/℃ 200 300 400 K K1 K2 0.5
①试比较K1、K2的大小,K1K2(填“<”“>”或“=”);
②400℃时,反应2NH3(g)⇌N2(g)+3H2(g)的化学平衡常数为。当测得NH3、N2和H2物质的量分别为3mol、2mol和1mol时,则该反应的v(N2)正v(N2)逆(填“<”“>”或“=”)。
③下列可用于判断N2(g)+3H2(g)≒2NH3(g)反应达到平衡状态的依据是。
A.容器中气体压强不再变化
B.容器中气体的密度不再变化
C.容器中气体平均摩尔质量不再变化
D.3v(H2)正=2v(NH3)逆组卷:3引用:1难度:0.5
三、实验题(每空2分,共12分)
-
21.某学生用0.1000mol/LKOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
①移取25.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
②用标准溶液润洗滴定管2~3次
③把盛有标准溶液的滴定管固定好,调节液面使滴定管尖嘴充满溶液
④取标准KOH溶液注入至0刻度以上2~3cm
⑤调节液面至0或0刻度以下,记下读数
⑥把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
(1)正确操作的顺序是(用序号填写)。
(2)步骤④中的滴定管是:(填“酸式滴定管”或“碱式滴定管”)。
(3)当步骤⑥待测液由色变为色,且半分钟内不变化即达到终点,KOH 溶液开始时读数及恰好反应时的读数见表。
请计算待测的盐酸的物质的量浓度实验编号 待测盐酸溶液体积(ml) 滴定开始读数(ml) 滴定结束读数(ml) ① 25.00 0.00 19.95 ② 25.00 1.10 18.30 ③ 25.00 0.20 20.25 mol/l(小数点后面保留4位数字)。
(4)由于操作失误,使得上述所测盐酸溶液的浓度偏高的是。
A.滴定达到终点时,俯视滴定管内液面读数
B.碱式滴定管用蒸馏水洗净后立即取用氢氧化钾溶液进行滴定
C.锥形瓶用蒸馏水洗净后未干燥就装入盐酸待测液
D.滴定时碱式滴定管中氢氧化钾溶液洒落在锥形瓶外组卷:14引用:6难度:0.6


