2022-2023学年湖北省武汉市重点中学4G+联合体高二(上)期中化学试卷
发布:2024/10/2 14:0:2
一、选择题(本题包括16小题,每题3分,共48分。每小题只有一个选项符合题意。)
-
1.化学与生产生活密切相关。下列措施与化学反应速率无关的有( )
①用鼓风机向炉膛内鼓风
②化工生产中将矿石粉碎再参与反应
③食物存放在冰箱
④糕点包装内放置除氧剂
⑤将固体试剂溶于水配成溶液后反应
⑥食品中加入着色剂组卷:9引用:1难度:0.8 -
2.用尿素水解生成的NH3催化还原NO,是柴油机车辆尾气净化的主要方法。反应为4NH3(g)+O2(g)+4NO(g)⇌4N2(g)+6H2O(g),下列说法不正确的是( )
组卷:10引用:1难度:0.8 -
3.下列说法正确且不能用勒夏特列原理解释的是( )
组卷:8引用:1难度:0.8 -
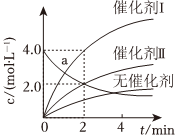 4.在相同条件下研究催化剂Ⅰ、Ⅱ对反应X→2Y的影响,各物质浓度c随反应时间t的变化的部分曲线如图,下列说法正确的是( )组卷:3引用:2难度:0.7
4.在相同条件下研究催化剂Ⅰ、Ⅱ对反应X→2Y的影响,各物质浓度c随反应时间t的变化的部分曲线如图,下列说法正确的是( )组卷:3引用:2难度:0.7 -
5.下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是( )
组卷:11引用:1难度:0.5 -
6.下列有关说法正确的是( )
组卷:10引用:1难度:0.8
第Ⅱ卷(非选择题共55分)
-
18.目前,常利用催化技术将汽车尾气中的NO和CO进行下列转化:2NO+2CO⇌2CO2+N2。为研究如何增大该化学反应的速率,某课题组进行了以下实验探究。
【提出问题】在其他条件不变的情况下,温度或催化剂的比表面积(单位质量的物质所具有的总面积)如何影响汽车尾气的转化速率?
【查阅资料】使用等质量的同种催化剂,催化剂的比表面积对催化效率有影响。
【实验设计】实验数据如表所示:
【图像分析与结论】三组实验中CO的浓度随时间的变化如图1所示(曲线Ⅰ表示实验Ⅰ)。编号 t/℃ c(NO)/(mol•L-1) c(CO)/(mol•L-1) 催化剂的比表面积/(m2•g-1) Ⅰ 280 6.50×10-3 4.00×10-3 80.0 Ⅱ t c1 4.00×10-3 120 Ⅲ 360 c2 4.00×10-3 80.0 
(1)实验数据表格中,t=;c2=。
(2)第I组实验中,从反应开始到达到平衡用时3min,用N2表示该反应在此段时间内的反应速率为。
(3)要得出催化剂的比表面积对催化效率的影响,应比较曲线和曲线(填“I”、“a”或“b”)。
(4)从影响反应速率的角度分析,由曲线Ⅰ和a可得出的结论是。
【拓展探究】该课题组进一步探究催化剂对CO、NO转化的影响。
(5)将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图2所示。
①若低于200℃,图2中曲线X脱氮率随温度升高而变化不大的主要原因为;
②m点(填“是”或“不是”)对应温度下的平衡脱氮率,说明你判断的理由。组卷:5引用:1难度:0.6 -
19.氢气是重要的工业原料,同时也是一种理想的二次能源。“制氢”“储氢”“用氢”一直都是能源研究的重点。
(1)煤的气化是一种重要的制氢途径。煤的气化发生反应如下
Ⅰ.C(s)+H2O(g)⇌CO(g)+H2(g)
Ⅱ.CO(g)+H2O(g)⇌CO2(g)+H2(g)
在一定温度下,向体积固定的密闭容器中加入足量的C(s)和1mol H2O(g),起始压强为0.2MPa时,发生上述反应生成水煤气。反应达到平衡状态时,H2O(g)的转化率为50%,CO的物质的量为0.1mol。该温度下,反应Ⅱ的平衡常数K=。
(2)镧镍合金是一种良好的储氢材料。向体积恒定的密闭容器中充入氢气发生如下反应:LaNi5(s)+3H2(g)⇌LaNi5H6(s)。H2的平衡转化率与其初始充入的物质的量(n)、反应温度(T)的关系如图a所示。
①该反应平衡常数的大小关系K(T1)K(T2)(填“>”“>”或“=”),理由是。
②图中,若不同温度下氢气平衡转化率相等,则氢气初始充入量由大到小的顺序是。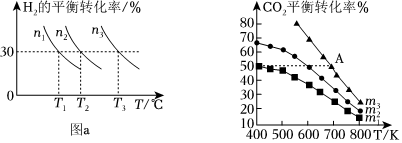
(3)工业用二氧化碳加氢可合成乙醇:2CO2(g)+6H2(g)⇌C2H5OH(g)+3H2O(g)。保持压强为5MPa,向密闭容器中投入一定量CO2和H2发生上述反应,CO2的平衡转化率与温度、投料比m(起始加入的H2与CO2的物质的量之比)的关系如图b所示。
①投料比m1、m2与m3由大到小的顺序为。
②若投料比m=1,一定温度下发生反应,在建立平衡过程中:
ⅰ.CO2的体积分数是否变化(填“是”或“否”)。
ⅱ.下列说法不能作为反应是否达平衡标志的是(填标号)。
a.容器内气体密度不再变化
b.容器内气体平均相对分子质量不再变化
c.CO2的体积分数不再变化
d.容器内H2与CO2的物质的量之比不再变化
e.断裂3NA个H—H键的同时生成1.5NA个水分子
③若m3=3,其他条件不变,A点对应起始反应物置于某恒容密闭容器中,则平衡时CO2的转化率50%(填“>”“=”或“<”)。组卷:8引用:1难度:0.5


