2023年辽宁省抚顺市清原县中考化学三模试卷
发布:2025/10/29 8:0:29
一、选择题(本题共15个小题,共20分。每小题只有一个选项符合题意。1-10小题,每小题1分;11-15小题,每小题1分)
-
1.如图所示是气体粒子的示意图,图中
 和
和 分别表示不同的原子,其中表示纯净物的是( )组卷:351引用:20难度:0.9
分别表示不同的原子,其中表示纯净物的是( )组卷:351引用:20难度:0.9 -
2.我国进入了创新型国家行列,科技发展日新月异。下列说法正确的是( )
组卷:8引用:1难度:0.7 -
3.下列叙述正确的是( )
组卷:31引用:1难度:0.9 -
4.下列实验操作正确的是( )
组卷:11引用:1难度:0.5 -
5.国产大飞机C919机壳采用了先进的铝锂合金材料。已知金属锂(Li)的活动性比铝强。下列说法错误的是( )
组卷:127引用:2难度:0.6 -
6.氧气(O2)和二氧化碳(CO2)的化学性质不同,其本质原因是( )
组卷:27引用:1难度:0.7 -
7.水是一种宝贵的自然资源。下列有关水的说法不正确的是( )
组卷:9引用:1难度:0.5 -
8.下列有关数据不正确的是( )
组卷:42引用:2难度:0.9 -
9.下列物质放入水中,能形成溶液的是( )
组卷:66引用:8难度:0.9 -
10.下列常见的现象中,一定发生化学变化的是( )
组卷:13引用:3难度:0.9 -
11.名称中有“水”字的物质可能是溶液,下列有“水”字的物质属于溶液的是( )
组卷:70引用:4难度:0.8 -
12.下列关于实验现象的描述,正确的是( )
组卷:25引用:2难度:0.6 -
13.某科技团队设想利用物质溶解时的降温效果,打造无电力冷却系统,他们选择的这种物质可能是( )
组卷:234引用:6难度:0.7 -
14.物质发生化学变化时伴随有能量变化。下列说法正确的是( )
组卷:1引用:0难度:0.7 -
15.鉴别、检验与分离是进行化学研究的重要方法。下列实验方案能达到实验目的的是( )
选项 实验内容 实验方案 A 除去黄泥水中的不溶性杂质 沉降、过滤 B 鉴别硬水和软水 加入肥皂水,搅拌,观察现象 C 除去过滤后的天然水中含有的颜色 活性炭吸附 D 鉴别氮气和二氧化碳气体 用燃着的木条,观察是否熄灭 组卷:16引用:1难度:0.5
二、填空题(本题包括4个小题,每空1分,化学方程式2分,共18分)
-
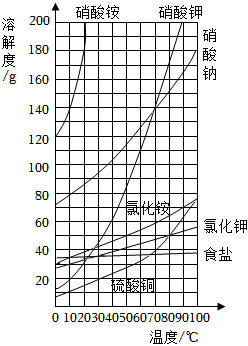 16.根据溶解度曲线及表中数据回答下列问题。
16.根据溶解度曲线及表中数据回答下列问题。
(1)如图中随着温度的变化溶解度变化较大的三种物质是,这类物质可以采取的方法从溶液中获得晶体。
(2)如图中硝酸钠和硝酸钾两种物质的溶解度曲线有一个交点,此交点的含义是。
(3)如表提供了硝酸钾固体在不同温度时的溶解度
①20℃时向100g水中加入40g硝酸钾,要使硝酸钾完全溶解,可以采取的措施是温度/℃ 0 20 40 60 80 溶解度/g 13.3 31.6 63.9 110 169 。
②现有60℃时的硝酸钾饱和溶液210g,若降温至20℃析出硝酸钾晶体的质量是g。
③表中对应的硝酸钾溶液溶质质量分数最大值为(精确到0.1%)。组卷:63引用:1难度:0.6 -
 17.铜、铁、铝是生产生活中广泛使用的金属。
17.铜、铁、铝是生产生活中广泛使用的金属。
(1)每年因金属锈蚀造成很大浪费,钢铁生锈实际是铁与空气中的发生化学反应,所以常在钢铁表面采取措施(只写一种),以防止钢铁生锈。
(2)如图是铝元素在元素周期表中的相关信息及其原子的结构示意图:
①如果把铝的相对原子质量近似为27,则氯原子的中子数为;氯原子在化学反应中容易电子成为铝离子(填“得”或“失”,铝离子符号为。
②在空气中打磨过的铝丝表面逐渐变暗,此变化过程可用化学方程式表示为。
(3)年代久远的铜器表面往往生有绿色铜锈,其主要成分是碱式碳酸铜[Cu2(OH)2CO3],化学性质类似于碱和碳酸盐。可用稀盐酸除去铜器表面上的铜锈,反应生成蓝色溶液和无色气体。写出稀硫酸和碱式碳酸铜反应的化学方程式:。组卷:13引用:1难度:0.3 -
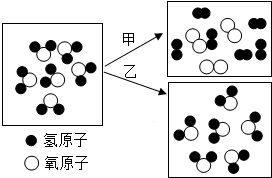 18.如图是水发生变化的微观结构模型.
18.如图是水发生变化的微观结构模型.
(1)甲、乙两变化中属于物理变化的是;从微观结构分析,该变化的特点是.
(2)甲、乙两变化中属于化学变化的是;写出该变化的文字表达式,反应类型为,从微观结构分析,该变化后物质的化学性质(填“发生了”或“未发生”)改变,原因.组卷:78引用:6难度:0.1 -
19.能源和环境问题是当今人类面临的两大问题.请你利用所学知识回答下列各题.
(1)在我国的能源结构中,煤炭所占比例很大,煤是一种(填“可再生”或“不可再生”).
(2)氢气是一种清洁的高能燃料,实验室制取氢气的化学方程式是.
(3)废弃塑料带来的“白色污染”很严重,塑料(填“属于”或“不属于”)合成材料.
(4)在日常生活中,我们每个人都应该该传播“低碳”理念,“低碳”中的碳是指(填物质名称).
(5)5月18日,国土资源部中国地质调查局在南海宣布,我国正在南海北部神狐海域进行的可燃冰试采获得成功,这也标志着我国成为全球第一个实现了在海域可燃冰试开采中获得连续稳定产气的国家.一辆使用可燃冰为燃料的汽车,理论上一次加100升可燃冰能跑5万公里,这将有可能改变整个世界的能源格局.可燃冰学名天然气水合物,其有效成分为甲烷,请写出甲烷的燃烧方程式.组卷:6引用:1难度:0.7
三、简答题(本题包括3个小题,每空1分、化学方程式2分,共16分)
-
20.阅读下列材料,回答相关问题。
Ⅰ.氢能作为一种储量丰富、来源广泛、能量密度高的清洁能源,已引起人们的广泛关注。光催化制氢气是采用太阳光照和催化剂条件下驱动水分解制氢气的新方法。2022年1月,我国科学家团队发表重要研究成果,成功制备Cu-TiO2新型催化剂。这种催化剂通过独特的合成工艺,将铜原子固定在二氧化钛纳米材料的空位中。在光催化制氢气反应过程中,一价铜阳离子和二价铜阳离子的可逆变化,大幅提高了电子的利用率,使水分解制氢气的效率大大提高。
(1)下列属于氢能优点的是。(填字母)
a.燃烧性能好,热值高
b.零污染排放
c.氢气易燃易爆
(2)在Cu-TiO2作催化剂的条件下,光催化制氢气的化学方程式是。
(3)写出一价铜阳离子的化学符号:。
(4)铜原子含量不同的Cu-TiO2催化剂在5小时内化水分解得到气产量如图A所示。选择铜原子含量为1.5%的Cu-TiO2催化剂的理由是。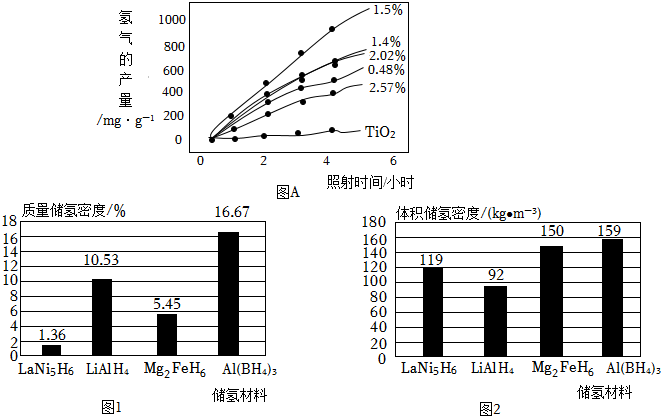
Ⅱ.金属氢化物储氢是把氢以氢化物的形式储存在金属或合金中。如图为一些储氢材料(以储氢后的化学式表示)的质量储氢密度(如图1)和体积储氢密度(如图2)。(已知:质量储氢密度=储氢后氢元素在储氢材料中的质量分数,体积储氢密度=储氢后单位体积的储氢材料中储存氢元素的质量)
(5)2m3储氢材料Mg2FeH6中储存氢元素的质量是kg;储氢材料LiH的质量储氢密度是%。组卷:89引用:1难度:0.7 -
21.用数字和化学符号表示:
(1)2个氢分子:。
(2)2个氢原子:。
(3)1个氯离子:。
(4)3个甲烷分子:。组卷:6引用:1难度:0.9 -
 22.小明把初中化学常见六种化合物A~F的相互关系如图所示,其中F的俗名是火碱、烧碱、苛性钠。(“→”表示物质之间存在转化关系,“—”表示能相互反应,部分反应物、生成物和反应条件已略去),请回答下列问题:
22.小明把初中化学常见六种化合物A~F的相互关系如图所示,其中F的俗名是火碱、烧碱、苛性钠。(“→”表示物质之间存在转化关系,“—”表示能相互反应,部分反应物、生成物和反应条件已略去),请回答下列问题:
(1)化合物F的化学式是。
(2)“B→C”的化学方程式是。组卷:51引用:2难度:0.4
四、实验与探究题(本题包括3个小题,每空1分、化学方程式2分,共18分)
-
23.根据如图所示的实验装置图回答问题:
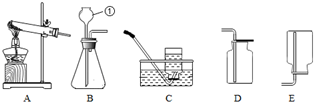
(1)写出图中编号仪器的名称:。
(2)实验室用双氧水制取氧气的化学方程式:;用排空气法收集氧气,检验氧气是否收集满的方法是。
(3)实验室用大理石和稀盐酸制取二氧化碳气体应选择的发生装置和收集装置是。(填字母,写出一种组合即可)组卷:5引用:1难度:0.5 -
24.通过观察和实验等方法获取证据是科学探究的重要环节。
(1)向少量Fe(OH)3沉淀中加入稀盐酸,观察到,可判断发生了反应。
(2)向Ca(OH)2溶液中通入CO2,观察到,可判断发生了反应。
(3)向氢氧化钙溶液中滴加稀盐酸,无明显现象。两位同学欲获取反应发生的证据。
①甲同学向滴有酚酞溶液的氢氧化钙溶液中,逐滴滴加稀盐酸至足量,溶液由红色变成无色,证明溶液中,可判断Ca(OH)2与HCl发生了反应。
②乙同学将氢氧化钙溶液与稀盐酸混合,然后检验了混合液中含有Ca2+和Cl-,他据此认为Ca(OH)2与HCl发生了反应,且生成了CaCl2。你认为乙同学是否找到了反应发生的证据?请说出你的观点并阐述理由:。
(4)如图a所示,向NaOH稀溶液中缓缓通入HCl气体,测定该过程中溶液导电能力的变化,实验结果如图b。(溶液体积、温度的变化可忽略)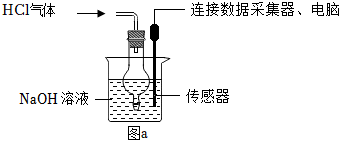
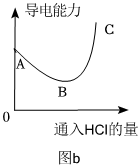
①分析A→B段变化,其他条件相同,导电能力:OH-Cl-。(填“>”“<”或“=”)
②分析B→C段变化,溶液的导电能力除了与离子种类有关,还与有关。组卷:621引用:2难度:0.5 -
 25.为探究稀硫酸的化学性质,某化学兴趣小组设计并完成了如图实验。
25.为探究稀硫酸的化学性质,某化学兴趣小组设计并完成了如图实验。
(1)实验过程中,A、B试管中的现象为,C试管中溶液由红色变为无色,其pH(填“一定”或“不一定”)等于7。
(2)A~D实验中,没有体现酸的化学通性的是(填实验序号)。
(3)实验结束后,同学们回收了A、B试管中的固体,并将C、D试管中的废液倒入大烧杯中,发现又产生了较多量沉淀。他们好奇烧杯内到底发生了什么反应,于是利用废液继续探究。
【查阅资料】氯化钡溶液和硫酸钠溶液均显中性。
【讨论与交流】写出C、D试管中的废液倒入大烧杯中时,产生大量沉淀的化学方程式【提出问题】 【猜想与假设】 【实验与事实】 实验步骤 实验现象 实验结论 实验一 C试管中反应后溶液中稀硫酸是否有剩余? 猜想1:有剩余
猜想2:无剩余向反应后的C试管中加入少量铁粉 无明显现象 猜想 成立实验二 大烧杯上层清液中除酚酞外还有哪些溶质? 猜想1:溶质有
猜想2:溶质有NaCl、Na2SO4、HCl
猜想3:溶质有NaCl、BaCl2、HCl取少量大烧杯中上层清液于试管中,用胶头滴管逐渐滴加 溶液生成白色沉淀 猜想3成立 。
【反思与评价】若将实验一中的铁粉换为碳酸钠溶液,观察到有气泡冒出,(填“可以”或“不能”)证明猜想1成立。组卷:16引用:2难度:0.7
五、计算题(本题2个小题,共8分)
-
26.碳元素和氢元素形成的一种化合物的相对分子质量为128,其中碳元素和氢元素的质量比为15:1.求此化合物的化学式,写出计算过程。
组卷:14引用:1难度:0.8 -
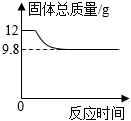 27.为测定10g氧化铜样品(含少量铜)中氧化铜的质量分数,在高温的条件下加入足量木炭粉使其完全反应,固体总质量随时间的变化如图所示:
27.为测定10g氧化铜样品(含少量铜)中氧化铜的质量分数,在高温的条件下加入足量木炭粉使其完全反应,固体总质量随时间的变化如图所示:
(1)完全反应后,产生二氧化碳的总质量是;
(2)试计算氧化铜样品中氧化铜的质量分数(写出计算过程)。组卷:343引用:5难度:0.5


