2021-2022学年江苏省泰州中学高三(上)质检化学试卷(12月份)
发布:2024/9/14 16:0:8
一、单项选择题:共14题,每题3分,共42分。每题只有一个选项最符合题意。
-
1.化学与生产、生活和社会发展密切相关,下列叙述正确的是( )
组卷:22引用:4难度:0.7 -
2.乙醛发生银镜反应的化学方程式为CH3CHO+2Ag(NH3)2OH
2Ag↓+CH3COONH4+3NH3↑+H2O。下列说法正确的是( )△组卷:64引用:3难度:0.6 -
3.阅读下列资料,完成3~5题:氮、磷、砷元素广泛应用于生产生活中,NH3、N2H4(肼)、NO、NO2、HNO3等是氮重要的无机化合物,白磷(P4)易自燃,易溶于CS2;Ca(H2PO4)2是磷肥的有效成分;砷化镓是重要的半导体材料.
下列关于氮、磷、砷三种元素及其单质、化合物的说法正确的是( )组卷:3引用:0难度:0.50 -
4.阅读下列资料,完成3~5题:氮、磷、砷元素广泛应用于生产生活中,NH3、N2H4(肼)、NO、NO2、HNO3等是氮重要的无机化合物,白磷(P4)易自燃,易溶于CS2;Ca(H2PO4)2是磷肥的有效成分;砷化镓是重要的半导体材料.
下列氮及其化合物的性质与用途不具有对应关系的是( )组卷:1引用:0难度:0.70 -
5.阅读下列资料,完成4~5题。
由于化石燃料的长期大量消耗,传统能源逐渐枯竭,而人类对能源的需求量越来越高,氢能源和化学电源的开发与利用成为全球发展的重要问题。
水合肼(N2H4•H2O)是重要的氢能源稳定剂,其制备的反应原理为NaClO+2NH3=N2H4•H2O+NaCl。下列装置和操作不能达到实验目的的是( )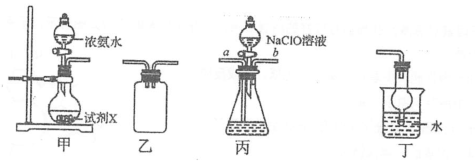 组卷:9引用:0难度:0.60
组卷:9引用:0难度:0.60
二、非选择题:共4题,共58分。
-
17.ClO2是一种强氧化性气体,在消毒和果蔬保鲜等方面应用广泛。ClO2易溶于水,易与碱液反应。ClO2浓度大时易分解爆炸,在生产和使用时必须用稀有气体或空气等进行稀释,实验室常用下列方法制备:2NaClO3+Na2SO3+H2SO4
2ClO2↑+2Na2SO4+H2O。△
(1)H2C2O4可代替Na2SO3制备ClO2,该反应的化学方程式为,该方法中最突出的优点是。
(2)为了便于运输和贮存,常将ClO2制备成NaClO2固体。某兴趣小组通过如图所示装置对其进行制备、收集、吸收并制取NaClO2。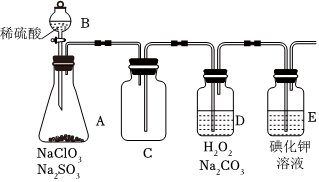
①图中装置有一明显错误,请指出:。
②打开B的活塞,A中有ClO2生成,D中吸收ClO2后生成NaClO2和NaHCO3写出D中所发生反应的离子方程式:。
③E中溶液出现黄色不能说明ClO2未被H2O2和Na2CO3的混合溶液充分吸收,可能的原因是:。
④E装置吸收逸出的少量ClO2气体后所得溶液(pH为5.5~6.5)中存在少量,当pH≤2时,ClO-2能被I-还原。请补充完整检验E装置溶液中存在少量ClO-2的实验方案:取一定体积E装置中的溶液于分液漏斗中,ClO-2,则溶液中存在。(实验中须使用的试剂有:CCl4、稀硫酸、淀粉溶液)ClO-2组卷:1引用:1难度:0.6 -
18.页岩气中含有CH4、CO2、H2S等气体,是蕴藏于页岩层可供开采的天然气资源。页岩气的有效利用需要处理其中所含的CO2和H2S。
Ⅰ.CO2的处理:
(1)CO2和CH4重整可制合成气(主要成分为CO、H2)。已知下列热化学反应方程式:
C(s)+2H2(g)═CH4(g);ΔH=-74.5kJ•mol-1
CO(g)+H2O(g)═CO2(g)+H2(g);ΔH=-40.0kJ•mol-1
C(s)+H2O(g)═CO(g)+H2(g);ΔH=+132.0kJ•mol-1
反应CO2(g)+CH4(g)═2CO(g)+2H2(g)的ΔH=kJ•mol-1。
(2)Ni催化CO2加H2形成CH4,其历程如图1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中CH4的百分含量及CO2的转化率随温度的变化如图2所示。
①260℃时生成主要产物所发生反应的化学方程式为。
②温度高于320℃,CO2的转化率下降的原因是。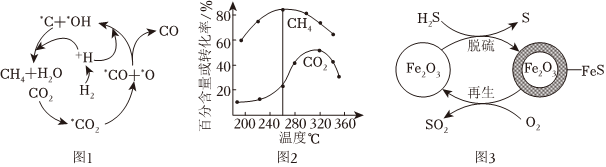
Ⅱ.H2S的处理:Fe2O3可用作脱除H2S气体的脱硫剂。Fe2O3脱硫和Fe2O3再生的可能反应机理如图3所示。
(3)Fe2O3脱硫剂的脱硫和再生过程可以描述为。
(4)再生时需控制通入O2的浓度和温度。400℃条件下,氧气浓度较大时,会出现脱硫剂再生时质量增大,且所得再生脱硫剂脱硫效果差,原因是。
(5)脱硫剂再生时可以使用水汽代替O2。700℃条件下,用水汽代替O2再生时,生成Fe3O4、H2S和H2,Fe3O4也可作脱硫剂。
①写出水汽作用条件下脱硫剂再生反应的化学方程式:。
②用O2再生时会生成污染性气体SO2,用水汽再生时会排放出有毒的H2S,采用O2和水汽混合再生的方法,可以将产生的SO2和H2S转化为S单质。则为不排放出SO2和H2S,理论上O2和水汽的体积比应为。组卷:139引用:6难度:0.6


