2023-2024学年江苏省南通市如皋一中高三(上)开学化学试卷
发布:2024/8/17 2:0:1
一、单项选择题(本大题共8小题,每题只有1个选项符合题意,每题2分,共16分)
-
1.化学与生活、科技、社会发展息息相关。下列有关说法正确的是( )
组卷:20引用:6难度:0.5 -
2.NCl3可发生水解反应NCl3+3H2O=NH3+3HClO,下列说法正确的是( )
组卷:33引用:1难度:0.8 -
3.侯氏制碱法又称联合制碱法,是我国化学工程专家侯德榜于1943年发明的,其主要反应为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl、2NaHCO3
Na2CO3+H2O+CO2↑。土法制烧碱的原理为Na2CO3+Ca(OH)2=2NaOH+CaCO3。下列有关钠及其化合物的性质与用途具有对应关系的是( )△组卷:13引用:6难度:0.8 -
4.前四周期主族元素X、Y、Z、W的原子序数依次增大,它们最外层电子数之和为20。常温下X的单质是一种淡黄绿色气体,基态Y原子核外有4个能级且均充满电子,Z的原子共有16种不同运动状态的电子。下列说法正确的是( )
组卷:22引用:1难度:0.7 -
5.在给定条件下,下列选项所示的物质间转化均能实现的是( )
组卷:233引用:33难度:0.5 -
6.如图为实验室制备ClO2并验证其氧化性的实验装置,实验过程中控制甲装置滴加硫酸溶液的量,其中表述不正确的是( )
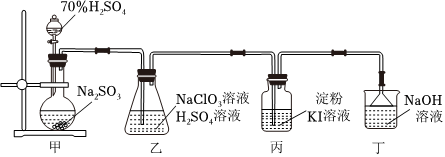 组卷:6引用:3难度:0.7
组卷:6引用:3难度:0.7
二、非选择题(共64分)
-
17.LiFePO4和Li2CO3都是重要的锂的化合物。
Ⅰ.LiFePO4电极材料是动力型锂离子电池的理想正极材料。它可以通过H3PO4、LiOH和(NH4)2Fe(SO4)2溶液发生共沉淀反应、将所得沉淀干燥、高温成型而制得。实验室制备LiFePO4的方法:
步骤1:将LiOH置于题图所示实验装置的三颈烧瓶中,加入煮沸过的蒸馏水,搅拌使其溶解。从分液漏斗中滴加H3PO4溶液,并持续通入氮气。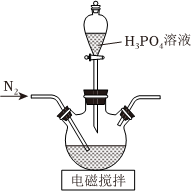
步骤2:将(NH4)2Fe(SO4)2固体溶于蒸馏水中,迅速倒入三颈烧瓶中,快速搅拌,充分反应后,过滤、洗涤滤渣得LiFePO4固体。
(1)共沉淀反应投料时,不将FeSO4和LiOH溶液直接混合的原因是。
(2)工业制取LiFePO4在高温成型前,常向LiFePO4中加入少量活性炭黑,其作用除了可以改善成型后LiFePO4的导电性能外,还能。
Ⅱ.磷酸锂渣(主要成分为Li3CO4)和废旧电极材料(含铝、炭、LiFePO4和FePO4)均可用于制取Li2CO3。
(3)实验室以磷酸锂渣为原料制备高纯Li2CO3的部分实验流程如图: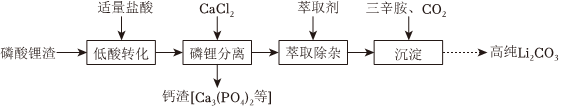
“低酸转化”使Li3PO4转化为Li2HPO4。写出“磷锂分离”的化学方程式:。
(4)已知:Li2CO3微溶于水;LiFePO4、FePO4难溶于水和碱,可溶于盐酸生成LiCl、FeCl2、FeCl3和H3PO4;pH>3.2时,Fe3+沉淀完全。完善由某废旧电极材料制取Li2CO3的实验方案:边搅拌边向废旧电极材料中加入NaOH溶液至不再产生气泡,过滤,,过滤、洗涤,低温干燥得Li2CO3固体。(实验中须使用的试剂有:双氧水、盐酸、NaOH溶液、Na2CO3溶液)组卷:20引用:5难度:0.6 -
18.CuS是一种重要的P型半导体材料。以一种石膏渣[含CaSO4及少量Cu(OH)2、Cu2(OH)2SO4、Zn(OH)2等]为原料制备CuS的实验流程如图:
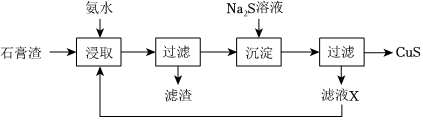
已知:常温下,Ksp(CuS)=1.27×10-36,Ksp(ZnS)=1.2×10-23。
(1)“浸取”时,生成[Cu(NH3)4]2+与[Zn(NH3)4]2+等。Cu2(OH)2SO4参加反应的离子方程式为。
(2)“沉淀”时Na2S溶液的用量不宜过多,其原因是。
(3)循环“浸取”多次后,“滤液X”中浓度增大的阳离子主要有。
(4)为测定“浸取”时Cu元素浸出率,需先测定石膏渣中Cu元素含量。称取50.00g石膏渣,加入足量稀H2SO4充分溶解,过滤并洗涤滤渣,将滤液转移至250mL容量瓶中,加水稀释至刻度;准确量取25.00mL稀释后的溶液于锥形瓶中,加入足量KI溶液(2Cu2++4I-=2CuI↓+I2),用0.02000mol⋅L-1Na2S2O3标准溶液滴定至终点(2S2+I2=S4O2-3+2I-),平行滴定3次,平均消耗Na2S2O3标准溶液23.50mL。计算石膏渣中Cu元素质量分数(写出计算过程)O2-6。组卷:16引用:5难度:0.6


