2022-2023学年重庆市西南大学附中高一(下)期末化学试卷
发布:2024/9/26 0:0:1
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选择中,只有一项是符合题目要求的。
-
1.据我国古代第一部药物学专著《神农本草经》记载:“石硫黄(即硫黄)能化金银铜铁锌奇物”,所得产物不可能是( )
组卷:16引用:1难度:0.5 -
2.下列事实能用勒夏特列原理解释的是( )
组卷:54引用:2难度:0.7 -
3.下列有关化学方程式书写正确的是( )
组卷:32引用:1难度:0.5 -
4.NA代表阿伏加德罗常数的数值。下列说法正确的是( )
组卷:36引用:1难度:0.7 -
5.下列说法正确的是( )
组卷:37引用:1难度:0.7 -
6.已知H2(g)+
O2(g)═H2O(g)ΔH=-242kJ•mol-1,断开1molO═O键和1molH-O键所吸收的能量分别为496kJ和463kJ,则断开1molH-H键所吸收的能量为( )12组卷:35引用:2难度:0.9
二、非选择题(本题包括4个小题,共58分)
-
17.二氧化铈可用在化妆品中起到抗紫外线作用,工业上以氟碳铈矿(CeCO3F,含Fe2O3、SiO2、Al2O3等杂质)为原料制备二氧化铈、硫酸铝铵晶体[NH4Al2(SO4)2]和硫酸亚铁铵[(NH4)2Fe(SO4)2]晶体,其工艺流程如图所示:
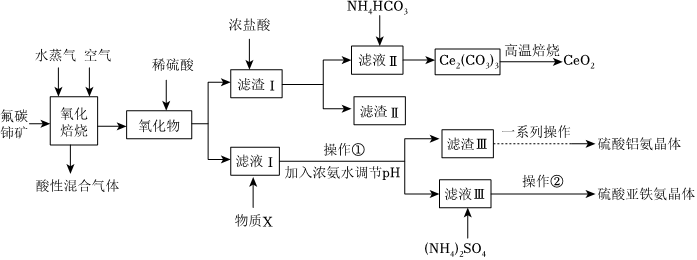
已知:①CeO2不溶于稀硫酸,也不溶于NaOH溶液,Ce2O3易溶于强酸。
②常见离子开始沉淀和完全沉淀pH表
回答下列问题:离子 Fe2+ Fe3+ Al3+ 开始沉淀时的pH 7.6 1.5 3.4 完全沉淀时的pH 9.6 2.8 4.7
(1)“氧化焙烧”时,气体与矿料逆流而行进行投料,其目的是,此时,发生化学方程式为。
(2)“滤渣Ⅰ”的主要成分是和(填化学式)。虽浓盐酸价格便宜,但用于溶解“滤渣Ⅰ”的缺点是,若用稀硫酸和双氧水代替浓盐酸,则发生反应的离子方程式为。
(3)“滤液Ⅰ”中加入物质X的目的是。
(4)“操作①”加入浓氨水调节pH后,溶液pH范围是。
(5)“滤渣Ⅲ”在制备硫酸铝铵晶体过程中,理论上需加入稀硫酸和(NH4)2SO4的物质的量之比为。组卷:37引用:1难度:0.5 -
18.CH3OH是一种重要的化工原料,广泛应用于化工生产,根据所学回答下列问题:
(1)工业上制备甲醇的反应方程式为:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
①写出该反应体系中CO2的电子式时间/h 1 2 3 4 5 6 P后P前0.90 0.85 0.83 0.81 0.80 0.80 。
②用H2表示前2h的平均反应速率v(H2)=。
③该温度下,CO2的平衡转化率为。
④在一定条件下,下列说法能说明该可逆反应达到平衡状态的是(填字母)。
A.容器中气体密度不变
B.容器中气体平均摩尔质量不变
C.v(CO2)正=3v(H2)逆
D.形成2molC=O键同时断裂3molH-H键
⑤在温度为T,压强为P的条件下,将CO2和H2按物质的量之比1:3通入一恒压密闭容器中发生上述反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=(用含P的表达式表示,其中用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)CH3OH制备丙烯的反应为:3CH3OH(g)⇌C3H6(g)+3H2O(g),速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为:Rlgk=-+RlgA(其中k为速率常数,反应速率与其成正比;Ea为活化能:R=8.314J⋅mol-1⋅K-1,A为常数)。Ea2.303T
①在一定条件下,测得实验数据如图曲线a所示。则该条件下,反应的活化能Ea=J⋅mol-1。
②若实验时改变外界条件,测得实验数据为如图曲线b所示,则可能改变的外界条件是(填标号)。
A.升高温度
B.增大压强
C.增大c(CH3OH)
D.更换适宜的催化剂组卷:24引用:2难度:0.5


