鲁科版(2019)选择性必修1《3.2 弱电解质的电离 盐类的水解》2023年同步练习卷(9)
发布:2024/8/17 4:0:1
一、选择题
-
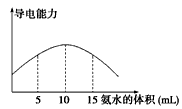 1.电离度是描述弱电解质电离程度的物理量,电离度=(己电离的物质的量/原来的总物质的量)X 100%.现取20mL pH=4的CH3COOH溶液,加入0.2mol•L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )组卷:34引用:2难度:0.7
1.电离度是描述弱电解质电离程度的物理量,电离度=(己电离的物质的量/原来的总物质的量)X 100%.现取20mL pH=4的CH3COOH溶液,加入0.2mol•L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )组卷:34引用:2难度:0.7 -
2.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
组卷:24引用:4难度:0.7 -
3.下列关于小苏打水溶液的表述正确的是( )
组卷:20引用:2难度:0.5
三、解答题
-
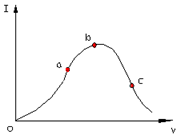 10.在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:
10.在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:
(1)a、b、c三点溶液中c(H+)由大到小的顺序为;
(2)a、b、c三点中醋酸电离度最大的是;
(3)若使c点溶液的c(CH3COO-)提高,在如下措施中可采取。(填标号)
A.通HCl气体
B.加Zn粒
C.加入固体KOH
D.加水
E.加固体CH3COONa组卷:15引用:2难度:0.5 -
11.Ⅰ.25℃时,三种酸的电离平衡常数如下:
(1)一般情况下,当温度升高时,Ka化学式 CH3COOH H2CO3 HClO 电离平衡常数 1.8×10-5 K1=4.3×10-7,K2=5.6×10-11 3.0×10-8 (填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力最强的是(填序号)。
a.CO32-
b.ClO-
c.CH3COO-
d.HCO3-
(3)下列反应不能发生的是(填序号)。
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
(4)用蒸馏水稀释0.10mol•L-1的醋酸,下列各式表示的数值随水量的增加而增大的是(填序号);
a.c(CH3COOH)c(H+)
b.c(CH3COO-)c(CH3COOH)
c.c(H+)Kw
d.c(H+)c(OH-)
Ⅱ.现有a.盐酸、b.醋酸、c.硫酸三种稀溶液,用字母回答下列问题。
①若三种酸的物质的量浓度相等。
(1)取等体积上述三种溶液与足量Zn反应,反应开始时,产生H2速率大小关系为,反应完成时产生H2体积大小关系为。
②若取等质量Zn分别跟这三种溶液反应,使Zn恰好完全反应时,消耗三种酸的体积大小关系为。
(2)若三种酸溶液中的c(H+)相等。
①三种酸的物质的量浓度大小关系为。
②取等体积上述三种溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH溶液体积大小关系为。组卷:66引用:2难度:0.7


