2023-2024学年北京市丰台区高二(上)期中化学试卷(B卷)
发布:2024/10/2 16:0:1
一、选择题(共42分)本部分共14小题,每小题3分,共42分。在每小题给出的四个选项中,选出最符合题意的一项。
-
1.下列装置或过程能实现电能转化为化学能的是( )

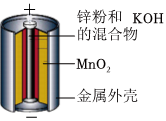

A.火力发电 B.碱性锌锰电池 C.电池充电 D.氢氧燃料电池 组卷:22引用:3难度:0.7 -
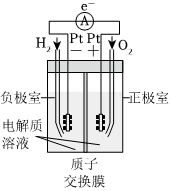
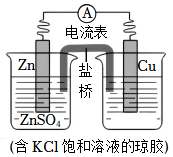 2.锌铜原电池装置如右图,下列说法不正确的是( )组卷:368引用:17难度:0.7
2.锌铜原电池装置如右图,下列说法不正确的是( )组卷:368引用:17难度:0.7 -
3.下列说法正确的是( )
组卷:317引用:13难度:0.8 -
4.在一定条件下发生反应2A(g)═2B(g)+C(g),将2mol A通入2L容积恒定的密闭容器甲中,若维持容器内温度不变,5min末测得A的物质的量为0.8mol.用B的浓度变化来表示该反应的速率为( )
组卷:106引用:9难度:0.7 -
5.下列事实不能用化学平衡移动原理解释的是( )
组卷:12引用:1难度:0.6 -
6.下列示意图与化学用语表述闪容不相符的是(水合离子用相应离子符号表示)( )
A B C D
NaCl溶于水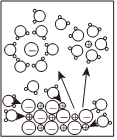
铜锌原电池工作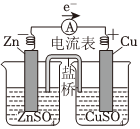
一种燃料电池工作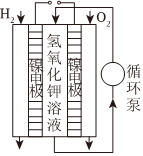
电解饱和食盐水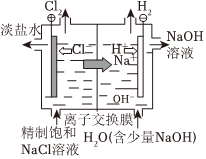
电离方程式:NaCl═Na++Cl- 总反应:Zn+Cu2+═Zn2++Cu 负极反应:H2-2e-+2OH-═2H2O 总反应:2Cl-+2H+ Cl2↑+H2↑通电组卷:63引用:3难度:0.7
二、非选择题(共58分)
-
18.合成氨是人类科学技术上的一项重大突破,氨有广泛的应用。
(1)目前工业合成氨的主要方法是HaberBosch法,化学反应原理如下:N2(g)+3H2(g)2NH3(g)。450℃/Fe200bar
①该反应放热,但仍选择较高温度,原因是。
②理论上,为了增大平衡时H2的转化率,可采取的措施是(写出1条)。
③将物质的量之比为1:3的N2和H2充入2L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
该条件下H2的转化率为物质 N2 H2 NH3 平衡时物质的量/mol 0.2 0.6 0.2 ,平衡常数K=(可用分数表示)。
④若按以下浓度投料,其它反应条件与①相同,起始时反应进行的方向为(填“正向”、“逆向”或“无法判断”)。
⑤L(L1、L2)、X可分别代表压强或温度。如图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。物质 N2 H2 NH3 起始浓度(mol/L) 0.5 1.5 0.5 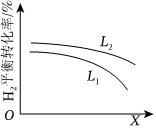
ⅰ.X代表的物理量是。
ⅱ.判断L1、L2的大小关系,并简述理由。
(2)电化学气敏传感器可用于检测环境中NH3的含量,其工作原理如图所示,则a极的电极反应式为。反应消耗的O2与NH3的物质的量之比为。 组卷:4引用:1难度:0.5
组卷:4引用:1难度:0.5 -
19.电化学原理在污染治理方面有着重要的作用。
Ⅰ.煤在直接燃烧前要进行脱硫处理。采用电解法脱硫的基本原理如图所示,利用电极反应将Mn2+转化为Mn3+,Mn3+再将煤中的含硫物质(主要成分是FeS2)氧化为Fe3+和:FeS2+15Mn3++8H2O=Fe3++15Mn2++2SO2-4+16H+。SO2-4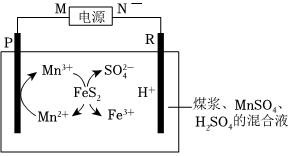
已知:两电极为完全相同的惰性电极。
回答下列问题:
(1)M为电源的(填“正极”或“负极”)。
(2)电解池工作时,观察到R电极上有无色气体产生,写出电极反应式。
(3)电解池工作时,混合液中的物质的量SO2-4(填“变大”、“变小”或“不变”)。
(4)电解过程中,混合溶液中的pH将(填“变大”、“变小”或“不变”),理由是。
Ⅱ.电解还原法处理酸性含铬废水:以铁板做阴、阳极,电解含铬废水,示意如图。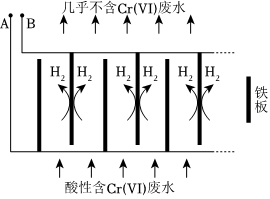
(1)电解开始时,A极上主要发生的电极反应式为。
(2)产生的Fe2+将Cr2还原为Cr3+的离子方程式为O2-7。
(3)随着电解的进行,阳极铁板会发生钝化,表面形成FeO•Fe2O3的钝化膜,使电解池不能正常工作。将阴极铁板与阳极铁板交换使用,一段时间后,钝化膜消失。结合有关反应,解释钝化膜消失的原因:。Ⅲ.微生物电池可用来处理废水中的对氯苯酚,原理如图所示。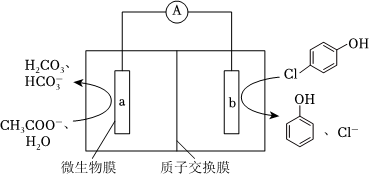
(1)该电池放电时,H+向(填“a”或“b”)极迁移。
(2)a极上生成H2CO3的电极反应为。
(3)已知b极的电极反应为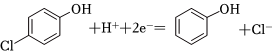 ,经处理后的水样中要求对氯苯酚的含量小于mmol/L。若废水中对氯苯酚的含量是nmol/L,则处理1m3废水,至少添加CH3COO-的物质的量为 mol(溶液体积变化忽略不计)。组卷:29引用:1难度:0.7
,经处理后的水样中要求对氯苯酚的含量小于mmol/L。若废水中对氯苯酚的含量是nmol/L,则处理1m3废水,至少添加CH3COO-的物质的量为 mol(溶液体积变化忽略不计)。组卷:29引用:1难度:0.7


