2022-2023学年辽宁省大连市滨城高中联盟高二(上)期中化学试卷
发布:2024/8/29 1:0:9
一、单选题(每题3分,共45分)
-
1.关于中和反应反应热的测定实验,下列说法正确的是( )
组卷:33引用:3难度:0.8 -
2.下列有关化学反应方向及判据的说法中不正确的是( )
组卷:151引用:3难度:0.6 -
3.下列关于电解质溶液的说法中正确的是( )
组卷:13引用:1难度:0.6 -
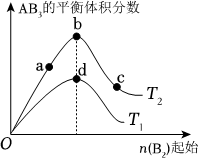 4.某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)⇌2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是( )组卷:28引用:2难度:0.7
4.某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)⇌2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是( )组卷:28引用:2难度:0.7 -
5.下列各组离子一定能大量共存的组合是( )
①在含有大量AlO2-溶液中:NH4+、Na+、Cl-、HCO3-
②常温下c(H+)=10-12mol⋅L-1的溶液:K+、Ba2+、Cl-、Br-
③常温下pH=7的溶液中:Na+、Cl-、SO42-、Fe3+
④在水溶液中:K+、SO42-、Cu2+、NO3-
⑤常温下c(OH-)=10-12mol⋅L-1的溶液:K+、Al3+、Cl-、SO42-
⑥常温下pH=1的溶液中:K+、CrO42-、Na+、SO42-组卷:75引用:5难度:0.6 -
 6.z下列关于如图所示转化关系(X代表卤素)的说法不正确的是( )组卷:21引用:2难度:0.7
6.z下列关于如图所示转化关系(X代表卤素)的说法不正确的是( )组卷:21引用:2难度:0.7
二、非选择题(共4大道题,55分)
-
18.工业用亚硝酸钠(NaNO2)通常含有Na2CO3,某工业杂志报道,对NaNO2含量的测定可以先测量出样品中Na2CO3的含量,再计算出NaNO2的纯度。
实验步骤如下:
第一步,称取5.300g工业用亚硝酸钠样品,配制成100.00mL溶液。
第二步,用碱式滴定管取上述待测试样25.00mL于锥形瓶中,加入酚酞试剂2~3滴,用0.05000mol⋅L-1的HCl标准溶液滴定至红色刚好褪去且半分钟不变化,消耗HCl标准溶液的体积为VmL,重复滴定两次。
(1)在碱式滴定管中装入待测试样后,要先排放滴定管尖嘴处的气泡,其正确的图示为(用相应的字母回答)。
A. B.
B. C.
C. D.
D.
(2)滴定到终点发生的反应为Na2CO3+HCl═NaCl+NaHCO3,滴定前后,HCl标准溶液的液面如图,则消耗HCl标准溶液的体积V=;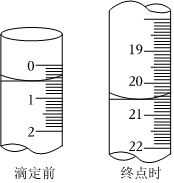
据此,杂质Na2CO3的质量百分数为(小数点后保留两位)。
(3)已知:pH≤1时,3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O。上述滴定过程中,NaNO2的存在并不影响测量结果,可能的原因是。
(4)25℃时,HNO2与NaNO2的混合溶液,若测得混合液pH=6,则溶液中c()-c(Na+)=NO-2(填准确数值)。
(5)下列操作会使NaNO2含量的测定结果偏低的是(填字母)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数组卷:10引用:1难度:0.6 -
19.研究CO2的回收利用既可变废为宝,又可减少碳的排放。回答下列问题:
二甲醚(CH3OCH)被誉为“21世纪的清洁燃料,由CO2和H2制备二甲醚的反应原理如下:
反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1=-akJ/mol(a>0)
反应Ⅱ:CH3OCH3(g)+H2O(g)⇌2CH3OH(g)ΔH2=+bkJ/mol(b>0)
反应Ⅲ:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)ΔH3
(1)ΔH3=kJ/mol,据此判断反应Ⅲ在(填“低温”、“高温”或“任意温度”)条件下能自发进行。
(2)恒温恒压条件下,在密闭容器中通入等物质的量的CO2和H2发生反应Ⅰ,能说明反应Ⅰ达到平衡状态的是(填字母序号)。
a.平衡常数保持不变
b.生成3molH-H键的同时断裂1molC-O键
c.容器内混合气体的密度保持不变
d.CO2和H2O的物质的量之比保持不变
(3)T1℃时,将1mol二甲醚充入某恒容密闭容器中,发生如下分解反应:CH3OCH3(g)⇌CH4(g)+H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表:
由表中数据计算:反应达平衡时,二甲醚的分解率为反应时间t/min 0 5 10 15 20 ∞ 气体总压p总/kPa p0 1.4p0 1.6p0 1.8p0 1.9p0 2p0 ,该温度下的平衡常数Kp=(kPa)2(Kp为用气体平衡分压代替气体平衡浓度表示的平衡常数,分压=总压×气体的物质的量分数)。
(4)恒压下将CO2和氢气按体积比1:3混合,在不同催化剂作用下发生反应Ⅰ和反应Ⅲ,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。其中:CH3OH的选择性=×100%。CH3OH的物质的量反应中CO2的物质的量
①在上述条件下,结合图象分析,合成甲醇的最佳温度是,最佳催化剂是。
②温度高于230℃,CH3OH产率随温度升高而下降的原因是。组卷:28引用:3难度:0.7


