2021-2022学年广东省广州市番禺中学高二(下)期中化学试卷
发布:2024/4/20 14:35:0
一、单选题(本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题2分。在每小题给出的四个选项中,只有一项是符合题目要求的。)
-
1.某有机物的键线式
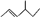 ,它的名称是( )组卷:101引用:5难度:0.9
,它的名称是( )组卷:101引用:5难度:0.9 -
2.现有四种元素基态原子的电子排布式如图。则下列有关比较中正确的是( )
①1s22s22p63s23p4
②1s22s22p63s23p3
③1s22s22p3
④1s22s22p5组卷:42引用:2难度:0.7 -
3.实验室制备硝基苯时,经过配制混酸、硝化反应(50~60℃)、洗涤分液、干燥蒸馏等步骤,下列图示装置和原理能达到实验目的的是( )
组卷:157引用:15难度:0.7 -
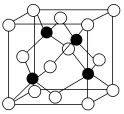 4.冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点及面心,实心球所示原子位于立方体内)类似。有关冰晶胞的说法合理的是( )组卷:28引用:7难度:0.6
4.冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点及面心,实心球所示原子位于立方体内)类似。有关冰晶胞的说法合理的是( )组卷:28引用:7难度:0.6 -
5.关于正丁烷(CH3-CH2-CH2-CH3)、异丁烷(
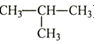 )的下列说法错误的是( )组卷:47引用:2难度:0.8
)的下列说法错误的是( )组卷:47引用:2难度:0.8 -
6.下列说法正确的是( )
组卷:37引用:5难度:0.9
二、解答题(共4小题,满分56分)
-
19.综合利用炼锌矿渣(主要含铁酸镓Ga2(Fe2O4)3、铁酸锌ZnFe2O4)获得3种金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓(GaN),部分工艺流程如图。

已知:①常温下,浸出液中各离子的浓度及其开始形成氢氧化物沉淀的pH如表1。
②金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)如表2。
表1金属离子浓度及开始沉淀的pH
表2金属离子的萃取率金属离子 浓度(mol•L-1) 开始沉淀pH Fe2+ 1.0×10-3 8.0 Fe3+ 4.0×10-2 1.7 Zn2+ 1.5 5.5 Ga3+ 3.0×10-3 3.0
(1)Ga2(Fe2O4)3中Ga的化合价为金属离子 萃取率(%) Fe2+ 0 Fe3+ 99 Zn2+ 0 Ga3+ 97~98.5 ,“浸出”时其发生反应的离子方程式为。
(2)滤液1中可回收利用的物质是,滤饼的主要成分是;萃取前加入的固体X为。
(3)Ga与Al同主族,化学性质相似。反萃取后,镓的存在形式为。(填化学式)
(4)电解过程包括电解反萃取液制粗镓和粗镓精炼两个步骤。精炼时,以粗镓为阳极,以NaOH溶液为电解液,阴极的电极反应为。
(5)GaN可采用MOCVD(金属有机物化学气相淀积)技术制得:以合成的三甲基镓为原料,使其与NH3发生系列反应得到GaN和另一种产物,该过程的化学方程式为。
(6)滤液1中残余的Ga3+的浓度为mol•L-1。(写出计算过程)组卷:367引用:9难度:0.5 -
20.铜及其化合物在生产生活中有着广泛的应用。回答下列问题:
(1)在元素周期表的分区中,铜属于区,与铜处于同一周期且最外层电子数相同的元素的基态原子共有种。
(2)元素铜和锌的第二电离能:I2(Cu)I2( Zn)(填“<”或“>”)。
(3)下列现代分析手段中,可用于检验水中痕量铜元素的是(填标号)。
A.X射线衍射
B.原子光谱
C.质谱
D.红外光谱
(4)CuCl2可与某有机多齿配体形成具有较强荧光性能的配合物,其结构简式如图所示。该配合物分子中N原子的杂化类型为,1mol该有机配体与Cu(Ⅱ)形成的配位键为mol。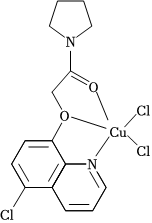
(5)铜催化烯烃硝化反应时会产生。键角:NO+2NO+2(填“<”或“=”或“>”),其原因是NO-2。
(6)近期我国科学家合成了一种电化学性能优异的铜硒化合物,其晶胞结构如图所示。该铜硒化合物的化学式为,其中Cu元素以Cu+和Cu2+存在,则(填“①”或“②”)为Cu2+,该晶体的密度为g•cm-3(用含a和c的式子表示,设阿伏加德罗常数的值为NA)。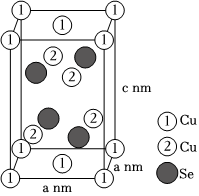 组卷:18引用:1难度:0.6
组卷:18引用:1难度:0.6


