人教版(2019)选择性必修1《1.2 反应热的计算》2023年同步练习卷(1)(2)
发布:2024/8/16 20:0:2
一、选择题
-
1.已知室温下,将 CuSO4•5H2O(s)溶于水会使溶液温度降低,将 CuSO4(s)溶于水会使溶液温度升高。 则下列能量转化关系的判断不正确的是( )
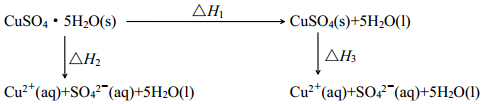 组卷:308引用:9难度:0.7
组卷:308引用:9难度:0.7 -
2.下列各组热化学方程式中,化学反应的△H或热量变化前者大于后者的是( )
①C(s)+O2(g)═CO2(g);△H1 C(s)+O2(g)═CO(g);△H212
②S(s)+O2(g)═SO2(g);△H3 S(g)+O2(g)═SO2(g);△H4
③t℃时,在一定条件下,将1mol SO2和1mol O2分别置于恒压和恒容的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2
④CaCO3(s)═CaO(s)+CO2(g);△H5 CaO(s)+H2O(l)═Ca(OH)2(s);△H6。组卷:3引用:3难度:0.6 -
3.已知:CO2(g)+C(s)=2CO(g)△H1
C(s)+H2O(g)=CO(g)+H2(g)△H2
CO(g)+H2O(g)=CO2(g)+H2(g)△H3
CuO(s)+CO(g)=Cu(s)+CO2(g)△H4
2CuO(s)+C(s)=2Cu(s)+CO2(g)△H5
下列关于上述反应焓变的判断不正确的是( )组卷:25引用:7难度:0.9 -
4.下列说法不正确的是( )
组卷:9引用:2难度:0.7
三、解答题
-
13.已知下列热化学方程式:
①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
②C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
③C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJ/mol
请回答:
(1)上述反应中属于放热反应的是(填序号,下同),属于吸热反应的是。
(2)2g H2完全燃烧生成液态水,放出的热量为。
(3)依据事实,写出下列反应的热化学方程式。
①1mol N2(g)与适量O2(g)反应生成NO(g),需吸收68kJ的热量,该反应的热化学方程式为。
②已知HCN稀溶液与NaOH稀溶液反应生成1mol H2O时,放出12.1kJ热量,用离子方程式表示该反应的热化学方程式为。
③在25℃、101kpa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为。组卷:11引用:4难度:0.6 -
14.回答下列问题:
(1)已知两种同素异形体A、B的燃烧热的热化学方程式为:
A(s)+O2(g)═CO2(g)△H=-393.51kJ/mol
B(s)+O2(g)═CO2(g)△H=-395.41kJ/mol
则两种同素异形体中较稳定的是(填“A”或“B”)。
(2)工业上用H2和Cl2反应制HCl,各键能数据为:H-H:436kJ/mol,Cl-Cl:243kJ/mol,H-Cl:431kJ/mol。该反应的热化学方程式是。
(3)合成气(CO和H2为主的混合气体)不但是重要的燃料也是重要的化工原料,制备合成气的方法有多种,用甲烷制备合成气的反应为:
①2CH4(g)+O2(g)═2CO(g)+4H2(g);△H1=-72kJ•mol-1
②CH4(g)+H2O(g)═CO(g)+3H2(g);△H2=+216kJ•mol-1
氢气与氧气反应生成水蒸气的热化学方程式为。现有1mol由H2O(g)与O2组成的混合气,且O2的体积分数为x,将此混合气与足量CH4充分反应。若x=0.2时,反应①放出的能量为kJ.若x=时,反应①与②放出(或吸收)的总能量为0。组卷:36引用:4难度:0.3


