人教版(2019)选择性必修1《3.2 水的电离和溶液的pH》2023年同步练习卷(2)
发布:2024/8/16 15:0:1
一、选择题
-
1.已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol•L-1的一元酸HA与b mol•L-1一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
组卷:2311引用:102难度:0.9 -
2.室温下,等体积的酸和碱的溶液混合后,pH一定小于7的是( )
组卷:68引用:4难度:0.5 -
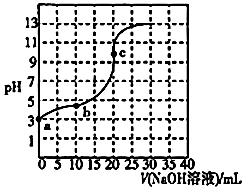 3.常温时,向20.00mL 0.1000mol•L-1一元酸HX的溶液中滴加0.1000mol•L-1的NaOH溶液,溶液的pH与加入的NaOH溶液的体积的关系如图所示.下列说法正确的是( )组卷:28引用:2难度:0.6
3.常温时,向20.00mL 0.1000mol•L-1一元酸HX的溶液中滴加0.1000mol•L-1的NaOH溶液,溶液的pH与加入的NaOH溶液的体积的关系如图所示.下列说法正确的是( )组卷:28引用:2难度:0.6 -
4.
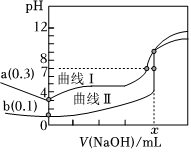 25℃时,用0.1000mol•L-1NaOH溶液分别滴定20.00mL 0.1000mol•L-1一元强酸甲的溶液和一元弱酸乙的溶液,滴定曲线如图所示.下列有关判断正确的是( )组卷:56引用:6难度:0.6
25℃时,用0.1000mol•L-1NaOH溶液分别滴定20.00mL 0.1000mol•L-1一元强酸甲的溶液和一元弱酸乙的溶液,滴定曲线如图所示.下列有关判断正确的是( )组卷:56引用:6难度:0.6 -
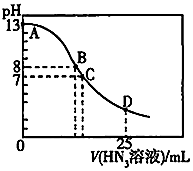 5.常温下,向25.00mL 0.1mol/LNaOH溶液中逐滴滴加0.2mol/L的HN3(叠氮酸)溶液,溶液的pH随加入的HN3溶液体积的变化曲线如图所示(溶液混合后体积的变化忽略不计,叠氮酸的Ka=10-4.7).下列说法正确的是( )组卷:22引用:2难度:0.6
5.常温下,向25.00mL 0.1mol/LNaOH溶液中逐滴滴加0.2mol/L的HN3(叠氮酸)溶液,溶液的pH随加入的HN3溶液体积的变化曲线如图所示(溶液混合后体积的变化忽略不计,叠氮酸的Ka=10-4.7).下列说法正确的是( )组卷:22引用:2难度:0.6 -
6.已知:pOH=-lgc(OH-)。室温下,向浓度为0.1mol•L-1的氨水中缓缓通入HCl,
随pOH的变化曲线如图所示。假设溶液体积没有变化,下列推断正确的是( )lgc(NH+4)c(NH3•H2O)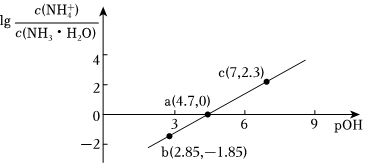 组卷:232引用:7难度:0.5
组卷:232引用:7难度:0.5
四、解答题
-
19.草酸合铁酸钾晶体[KaFeb(C2O4)c•xH2O](Fe呈+3价)是一种光敏材料,为测定该晶体中草酸根的含量和结晶水的含量,某实验小组实验步骤为:
(1)称量9.820g草酸合铁酸钾晶体,配制成250mL溶液.
(2)取所配溶液25.00mL于锥形瓶中,滴加酸性KMnO4溶液至C2O42-全部转化成CO2,同时MnO4-被转化成Mn2+,恰好消耗0.1000mol•L-1KMnO4溶液24.00mL
(3)另取所配溶液25.00mL,向其中加入过量的NaOH溶液,振荡使其充分反应,待沉淀完全后,过滤,洗涤并灼烧,最终得到红色固体质量0.16g.
(已知:5C2O42-+2MnO4-+16H+═2Mn2++10CO2↑+8H2O)
则该晶体的化学式为:(写出计算过程)组卷:15引用:1难度:0.7 -
20.利用K2Cr2O7标准溶液可以定量测定市售硫代硫酸钠试剂的纯度.测定步骤如下:
(a)溶液配制:称取1.3000g硫代硫酸钠试样,用新煮沸并冷却的蒸馏水溶解后,加入少量碳酸钠固体,定容至100mL,避光放置7天.
(b)滴定:取10.00mL浓度为0.01000mol/L的K2Cr2O7标准溶液,加入硫酸酸化后再加过量KI溶液(发生反应:Cr2O72-+I-→I2+Cr3+).然后加入某指示剂,用硫代硫酸钠滴定至终点(发生的反应为2S2O32-+I2═S4O62-+2I-).记录硫代硫酸钠溶液的用量,平行滴定3次.回答下列问题.
(1)步骤(a)中必须用到的玻璃仪器有烧杯、玻璃棒、
(2)完成并配平步骤(b)中给出的反应Cr2O72-+I-+═+Cr3++I2
(3)滴定过程中,指示剂应选用,判断滴定达到终点的现象是.
(4)滴定前滴定管尖嘴部分有气泡,滴定结束后气泡消失,将导致硫代硫酸钠试剂的纯度(填“偏大”、“偏小”或“无影响”).
(5)若Na2S2O3溶液的平均用量为12.00mL,样品的纯度为(Na2S2O3•5H2O的摩尔质量为248g/mol,结果保留两位有效数字)组卷:34引用:3难度:0.3


