人教版(2019)选择性必修1《2.2.3 影响化学平衡的因素(一) 浓度、压强对化学平衡的影响》2023年同步练习卷(1)
发布:2024/8/16 18:0:1
一、选择题
-
1.对处于化学平衡的体系,由化学平衡与化学反应速率的关系可知( )
组卷:106引用:9难度:0.7 -
2.在一定条件下,反应2SO2(g)+O2(g)⇌2SO3(g)达到了平衡,改变某一条件,发生下述变化,其中可确定该平衡一定发生移动的是( )
组卷:22引用:9难度:0.5 -
3.已知银氨溶液中存在如下平衡:[Ag(NH3)2]⇌Ag++2NH3.向银氨溶液中加入或通入少量下列物质时,能使上述平衡向逆反应方向移动的是( )
组卷:28引用:4难度:0.5 -
4.在一密闭容器中发生反应:2A(g)+2B(g)⇌C(s)+3D(g)ΔH<0,达到平衡时采取下列措施,可以使正反应速率v正增大、D的物质的量浓度c(D)增大的是( )
组卷:12引用:2难度:0.6 -
5.已知化学反应2A(?)+B(g)⇌2C(?)达到平衡,当增大压强时,平衡向逆反应方向移动,则下列选项正确的是( )
组卷:74引用:5难度:0.6 -
6.恒温下,反应aX(g)⇌bY(g)+cZ(g)达到平衡后,把容器体积压缩到原来的一半且达到新平衡时,X的物质的量浓度由0.2mol/L增大到0.35mol/L,下列判断正确的是( )
组卷:61引用:5难度:0.9
二、解答题
-
18.根据外界条件对化学平衡的影响回答下列问题:
(1)碘单质难溶于水却易溶于KI溶液。碘水中加入KI溶液发生反应I2(aq)+I-(aq)⇌I3-(aq),下列说法不正确的是。
a.上述体系中加入苯,平衡不移动
b.可运用该反应原理除去硫粉中少量的碘单质
c.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液
d.加入AgNO3溶液平衡向左移动
(2)某温度下,体积一定的密闭容器中进行反应N2(g)+3H2(g)⇌2NH3(g)△H<0
①下列分析正确的是。
a.平衡后,加入N2,该反应的△H增大
b.平衡后,加入催化剂,该反应的△H不变
c.平衡后,充入NH3,新平衡时,NH3的百分含量变大
d.若反应前充入的N2与H2物质的量相等,达平衡时N2的转化率比H2的高
②欲提高H2的转化率,下列措施可行的是。
a.缩小容器体积
b.向容器中按原比例再充入N2和H2
c.向容器中再充入惰性气体
d.液化NH3并分离组卷:17引用:3难度:0.5 -
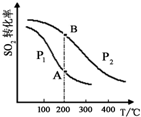 19.研究硫及其化合物的性质有重要意义.
19.研究硫及其化合物的性质有重要意义.
(1)硫酸工业生产中涉及反应:2SO2(g)+O2(g)⇌2SO3(g),SO2的平衡转化率与温度、压强的关系如图所示:
①压强:P1P2(填“>”、“=”或“<”);
②平衡常数:A点B点(填“>”、“=”或“<”);
③200℃下,将一定量的SO2和O2充入体积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
能说明该反应达到化学平衡状态的是气体 SO2 O2 SO3 浓度(mol/L) 0.4 1.2 1.6 ;
a.SO2和O2的体积比保持不变 b.体系的压强保持不变
c.混合气体的密度保持不变 d.SO2和SO3物质的量之和保持不变
计算上述反应在0~10min内,v(O2)=;
(2)一定温度下,用水吸收SO2气体,若得到pH=3的H2SO3溶液,试计算溶液中c(HSO3-)/c(SO32-)
=.(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2mol/L,Ka2=6.0×10-3mol/L)组卷:7引用:2难度:0.5


