2022-2023学年山西省太原师院附中、师苑中学高二(上)第一次月考化学试卷
发布:2024/5/22 8:0:8
一、选择题(单选,本大题共20小题,每小题2分,共40分)
-
1.下列各组变化中,前者是放热反应,后者是吸热反应的是( )
组卷:34引用:4难度:0.8 -
2.下列为可逆反应:A(g)+3B(g)⇌2C(g)+2D(g)在不同条件下的化学反应速率,其中表示的化学反应速率最快的是( )
组卷:28引用:3难度:0.6 -
3.下列示意图表示正确的是( )
组卷:57引用:12难度:0.5 -
4.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的( )
①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaCl固体 ⑥KCl溶液组卷:55引用:6难度:0.6 -
5.已知:①2H2(g)+O2(g)=2H2O(g)ΔH1;
②2Fe(s)+O2(g)=Fe2O3(s)ΔH2;32
③2Al(s)+O2(g)=Al2O3(s)ΔH3;32
④2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s)ΔH4。
下列关于反应焓变的判断正确的是( )组卷:183引用:7难度:0.6 -
6.下列有关热化学方程式的叙述,正确的是( )
组卷:20引用:3难度:0.7 -
7.一定条件下,在一氧化碳变换反应CO+H2O⇌CO2+H2中,有关反应条件改变使反应速率增大的原因分析错误的是( )
组卷:11引用:4难度:0.7 -
8.将一定量纯净的氨基甲酸铵固体置于密闭真空容器中(容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s)⇌2NH3(g)+CO2(g)下列各项
①2v(NH3)=v(CO2);
②密闭容器中压强不变;
③密闭容器中混合气体的密度不变;
④密闭容器中氨气的体积分数不变;
⑤密闭容器中c(NH3)不变。
能判断该反应已经达到化学平衡状态的是( )组卷:137引用:4难度:0.5
二、非选择题(本大题共5个小题,共60分)
-
25.某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾溶液与草酸溶液(分子式为H2C2O4,二元弱酸)的反应,记录如表所示的实验数据:
(1)发生反应的离子方程式为编号 实验温度 试管中所加试剂及其用量/mL 溶液至无色所需时间/min 0.6mol/L H2C2O4溶液 H2O 3mol/L H2SO4溶液 0.05mol/LKMnO4溶液 ① 25°C 3.0 V1 2.0 3.0 1.5 ② 25°C 2.0 3.0 2.0 3.0 2.7 ③ 50°C 2.0 V2 2.0 3.0 1.0 。
(2)V1=mL,V2=mL。
(3)根据表中的实验①、②数据,可以得到的结论是。
(4)探究温度对化学反应速率的影响,应选择(填实验编号)
(5)用③组数据计算,当反应进行完全v(KMnO4)=。
(6)该小组根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。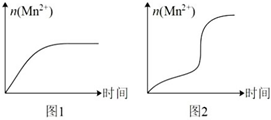
该小组同学根据图2所示信息提出了新的假设,并设计实验方案④继续进行实验探究。
该小组同学提出的假设是编号 温度 试管中所加试剂及其用量/mL 再加入某种固体 溶液褪至无色所需时间/min 0.6mol/LH2C2O4溶液 H2O 3mol/LH2SO4溶液 0.05mol/LKMnO4溶液 ④ 25°C 2.0 3.0 2.0 3.0 MnO4 t 。若该小组同学提出的假设成立,应观察到现象。组卷:17引用:1难度:0.9 -
26.煤、石油等传统能源使用时污染严重,且日渐枯竭,科学家们寻找其他清洁能源作为替代品,其中甲烷的开发利用成为一个热点。以下是甲烷水蒸气重整的应用:
已知:甲烷水蒸气重整原理CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) ΔH3=+165kJ/mol。
(1)向恒容容器中加入1molCH4和2molH2O,在恒定的温度,初始压强aMPa下进行反应。
①当分离出0.8molH2时,分离比η=(分离比η=,实际H2分离量与CH4完全转化时得到的H2量的比例,体现H2分离的程度)。n(H2)4n(CH4)
②如图是甲烷平衡转化率与温度、H2分离比的关系,其中η1、η2、η3的由大到小的关系是。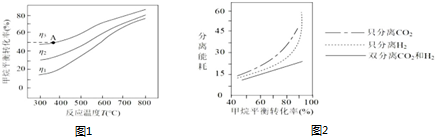
③η3=0.25时,A点气体的总压p(总)aMPa(填“>”、“=”、“<”);H2的分压p(H2)=MPa;平衡常数Kp=(MPa)2。
(2)从反应体系中分离出H2、CO2需要消耗能量(分离能耗),不同分离方式需要的分离能耗与甲烷平衡转化率的关系如图2所示,在提供相同的分离能量时,哪种分离方式更有利于提高甲烷平衡转化率。组卷:39引用:1难度:0.5


