2022-2023学年上海市松江二中高二(下)期末化学试卷(等级考)
发布:2024/5/23 8:0:8
物质合成与制备
-
1.2023年6月4日,神舟十五号载人飞船返回舱在东风着陆场成功着陆,我国航天事业再攀高峰。火箭发射常用强还原性的肼类燃料,实验室用NH3与Cl2合成肼(N2H4)的装置如图所示,请回答下列问题:
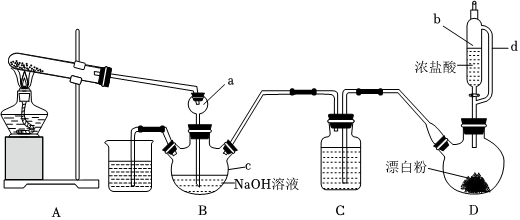
(1)仪器b的名称为,导管d的作用是。
(2)按图连接装置,盛放试剂前,首先要进行操作。装置中仪器a的作用除了导气还有。
(3)装置D中发生的化学反应方程式为。
(4)装置C中的试剂是。
(5)装置B中制备N2H4的离子方程式为。
(6)实验室对产品中N2H4的质量分数进行测定。已知:N2H4+2I2=N2↑+4HI。取装置B的溶液6.00g,调节溶液pH为6.5左右,加水配成500mL溶液,移取25.00mL于锥形瓶中,滴加2~3滴淀粉溶液,用0.2000mol•L1的I2溶液滴定(杂质不参与反应),滴定终点的现象是,测得消耗I2溶液的体积为20.00mL,则该产品中N2H4的质量分数为%(保留3位有效数字)。组卷:18引用:1难度:0.6
氧化还原反应与电化学
-
4.Ⅰ.党的二十大报告中着重强调了生态文明建设的重要性,在这场蓝天保卫战中,如何有效脱除NOx是当前科学家研究的重要课题。
(1)碱性KMnO4氧化法可将NOx进行脱除。
①KMnO4(NaOH)溶液进行烟气中NO的脱除,将该离子方程式补充完整。NO++MnO-4=+3NO-2+10NO-3+MnO2-4
②下列叙述错误的是(多选)。
A.将脱除后的混合溶液进行分离可获得铵态氮肥
B.反应后混合溶液中:[]+[MnO-4]=[K+]MnO2-4
C.在不同酸碱性条件下,KMnO4发生氧化还原反应的产物可能不同
D.中的O-N-O键角大于NO-2中的O-N-O键角NO-3
③在实验室用KMnO4(NaOH)溶液对模拟烟气中的NO进行脱除。若将标准状况下224L含NO体积分数为10%的模拟烟气进行处理,假设NO最终全部转化为,理论上需要KMnO4的质量为NO-3g。
(2)用Pl-g-C3N4光催化氧化法脱除NO的过程如图所示。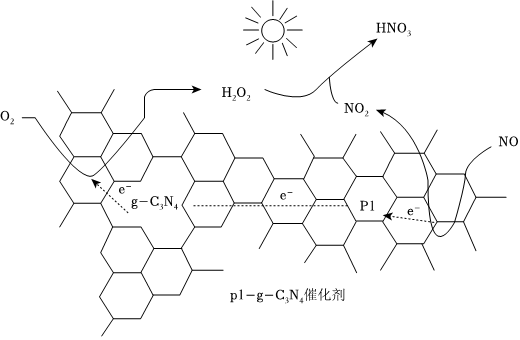
在酸性水溶液中,光催化脱除原理和电化学反应原理类似。g-C3N4端的反应为O2+2H++2e-=H2O2,P1端的反应为。
Ⅱ.无害化处理水体中的含氮化合物(以NH3、、NO-3等形式存在)也是生态文明建设的重要环节之一。NO-2
(3)向该酸性废水(主要是以形式存在)中加入NaClO溶液可将NH+4转化成无害气体放出,发生反应的离子方程式为NH+4;NaClO可以通过Cl2与NaOH溶液反应制得,该反应中氧化剂与还原剂的物质的量之比为。
(4)使用NH3时也要注意防止污染环境。电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图: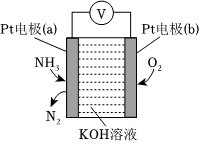
①Pt电极(a)为极(填“正”或“负”);Pt电极(b)上的电极反应式为。
②电池总反应的化学反应方程式为,反应一段时间后,KOH溶液的浓度将(填“增大”“减小”或“不变”)。组卷:42引用:1难度:0.5
化学工艺流程
-
5.锌是生命中不可或缺的微量元素,有“生命火花”之称。硫酸锌常用作动植物补锌试剂,工业上,硫酸锌可由菱锌矿制备,菱锌矿的主要成分为ZnCO3,杂质为SiO2以及Ca、Mg、Fe、Cu等的化合物。其制备流程如图:

本题中所涉及离子的氢氧化物溶度积常数如下表:
回答下列问题:离子 Fe3+ Zn2+ Cu2+ Fe2+ Mg2+ Ksp 4.0×10-38 6.7×10-17 2.2×10-20 8.0×10-16 1.8×10-11
(1)菱锌矿焙烧生成氧化锌的化学方程式为。
(2)为了提高锌的浸取效果,可采取的措施有、。
(3)加入物质X调节溶液pH=5,以下试剂能实现该目的是(多选)。
A.NH3•H2O
B.Ca(OH)2
C.NaOH
D.MgO
①的主要成分是。
(4)向80~90℃的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2,该反应的离子方程式为。
(5)滤液②中加入锌粉的目的是。
(6)滤渣④与浓H2SO4反应可以释放HF并循环利用,同时得到的副产物是。
(7)硫酸锌溶液与过量氨水反应可生成配离子[Zn(NH3)4]2+,其结构如图所示:
①请在结构图中用箭头标出配位键;
②该配离子所含配体的分子空间构型为。组卷:18引用:1难度:0.7


