2022-2023学年浙江省宁波市五校高二(上)期中化学试卷
发布:2024/10/3 3:0:2
一、选择题(本大题有25小题,每小题2分,共50分,每小题只有1个正确答案)
-
1.电离理论的创立的化学家是( )
组卷:4引用:2难度:0.5 -
2.下列物质的水溶液因水解呈酸性的是( )
组卷:21引用:3难度:0.7 -
3.25℃时,向水中加入下列物质,能使水电离出的c(H+)>1.0×10-7mol/L的是( )
组卷:4引用:2难度:0.8 -
4.下列关于盐的水解应用不正确的是( )
组卷:9引用:2难度:0.8 -
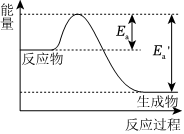 5.在一定温度下,某反应达到了化学平衡,其反应过程对应的能量变化如图。下列说法不正确的是( )组卷:2引用:2难度:0.8
5.在一定温度下,某反应达到了化学平衡,其反应过程对应的能量变化如图。下列说法不正确的是( )组卷:2引用:2难度:0.8 -
6.常温下,pH=13的强碱溶液与pH=2的强酸溶液混合,(体积变化忽略不计)所得混合液的pH=11,则强碱与强酸的体积比是( )
组卷:239引用:52难度:0.7 -
7.下列有关叙述中正确的是( )
组卷:8引用:2难度:0.5 -
8.属于正确的水解反应离子方程式的是( )
组卷:9引用:2难度:0.9 -
9.下列与熵有关的叙述中不正确的是( )
组卷:7引用:2难度:0.5
二、非选择题(本大题有4小题。)
-
28.N2O5是一种常用的硝化剂,常用N2O4的臭氧化法制备,反应原理如下:
反应Ⅰ:N2O4(g)+O3(g)⇌N2O5(g)+O2(g) ΔH1
反应Ⅱ:2NO2(g)⇌N2O4(g) ΔH2=+57kJ•mol-1
(1)298K时,几种物质的相对能量如下表:
请可根据物质的相对能量计算反应Ⅰ的ΔH1物质 O2(g) O3(g) NO2(g) N2O4(g) N2O5(g) 能量(kg/mol) -90 -14 -62 -181 -198 。(忽略ΔH随温度的变化)。
(2)在密闭容器中充入1molN2O4和1molO3,发生反应Ⅰ和Ⅱ。
①在恒温恒压条件下,下列说法正确的是。
A.N2O5和O2的物质的量之比不变时说明反应已达平衡
B.v正(N2O4)=2v逆(NO2)说明反应Ⅱ已达到平衡
C.混合气体密度不再改变说明反应Ⅰ已达到平衡
D.反应达到平衡后,再往容器中通入稀有气体Ar,反应Ⅰ平衡不移动
②保持温度不变,对反应体系加压,平衡时O3的转化率α(O3)与压强的关系如图所示。请解释压强增大至p1MPa的过程中α(O3)逐渐增大的原因:。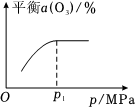
③以固体催化剂M催化反应Ⅰ,若O3分子首先被催化剂的活性表面吸附而解离,该反应机理分为两步,写出第一步的化学方程式:步骤a.;步骤b.N2O4+MO=M+N2O5。
(3)T℃时,在密闭容器中充入1molN2O4,保持压强不变,只发生反应Ⅱ,t1时到达平衡,v正随时间的变化如图所示,在t2时刻继续充入一定量的N2O4,t3时刻重新到达平衡,请在图中作出v逆随时间变化的曲线。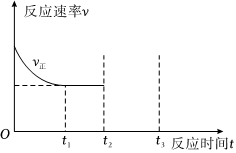 组卷:3引用:2难度:0.6
组卷:3引用:2难度:0.6 -
29.合理利用温室气体是当前能源与环境研究的热点。CO2催化加氢可缓解CO2对温室效应的影响,其原理为:
反应Ⅰ:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH1
反应Ⅱ:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41kJ•mol-1
(1)已知25℃相关物质的燃烧热数据如下表:
已知H2O(l)=H2O(g) ΔH=+44kJ•mol-1,则ΔH1=物质 H2(g) CH4(g) 燃烧热ΔH(kJ•mol-1) -285.8 -890.3 kJ•mol-1。
(2)反应Ⅱ的ΔS0(填“>”、“<”或“=”),请说明理由
(3)反应Ⅱ中,正反应速率:V正=k正c(CO2)•c(H2),逆反应速率:V逆=k逆c(CO)•c(H2O),其中k正、k逆分别为正、逆反应速率常数,仅受温度影响。如图(pk=-lgk,T表示温度)所示a、b、c、d四条斜线中,有两条分别为pk正和pk逆随T变化斜线,则表示pk逆随T变化关系的斜线是。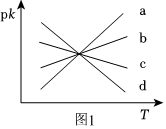
(4)在0.1MPa下,将1molCO2和4molH2充入2L刚性密闭容器中,反应相同时间,温度对CO2转化率如图所示。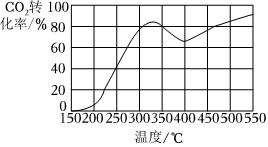
①解释CO2转化率在高于325℃时,随温度升高先减小后增大的原因。
②假设只发生反应Ⅱ,当CO平衡产率为40%时,此时总压为P。计算该温度下反应Ⅱ的平衡常数Kp为。(计算结果用分数表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)组卷:6引用:2难度:0.5


