2022-2023学年上海市育才中学高二(下)期末化学试卷(等级考)
发布:2024/8/2 8:0:9
化学反应的热效应
-
 1.(1)下列反应中,生成物总能量高于反应物总能量的是 。
1.(1)下列反应中,生成物总能量高于反应物总能量的是 。
A.强酸强碱的中和反应
B.酒精燃烧
C.Ba(OH)2•8H2O(s)与氯化铵(s)混合
D.SO2催化氧化制取SO3
(2)化学家借助太阳能产生的电能和热能,用空气和水作原料成功地合成了氨气。下列说法错误的是。
A.该过程中电能转化为了化学能
B.该过程属于氮的固定
C.太阳能为可再生资源
D.断裂N≡N键会释放出能量
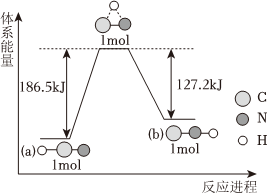
(3)研究表明,在一定条件下,气态HCN(a)与HNC(b)两种分子的互变反应过程能量变化如图所示。下列说法正确的是。
A.HNC比HCN更稳定
B.HCN转化为HNC,反应条件一定要加热
C.HNC(g)=HCN(g) ΔH=-59.3kJ•mol-1
D.加入催化剂,可以减小反应的热效应
(4)①甲烷可用于生产合成气,反应为:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.4kJ•mol-1,已知几种物质中化学键的键能如下表所示:则a=。
②科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:化学键 H-H O-H C-H C≡O 键能/(kJ•mol-1) 436 465 a 1076
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为。组卷:48引用:1难度:0.5
有机化学
-
4.(1)下列官能团名称、结构简式对应正确的是
。
A.脂基:-COO-
B.羧基:HOOC-
C.醛基:-COH
D.碳碳双键:-C=C-
(2)乙烯的相关转化关系如图。下列有关说法正确的是。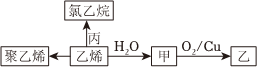
A.甲与乙醚互为同分异构体
B.甲→乙的反应类型为加成反应
B.丙为氯气
D.聚乙烯不是纯净物
(3)下列有关苯乙烯(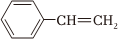 )的说法正确的是 。
)的说法正确的是 。
A.最多有8个原子共面
B.是苯的同系物
C.加聚产物的含碳量与乙炔相同
D.可与4mol溴发生加成反应
(4)一种抗癌药物中间体G的合成路线如图: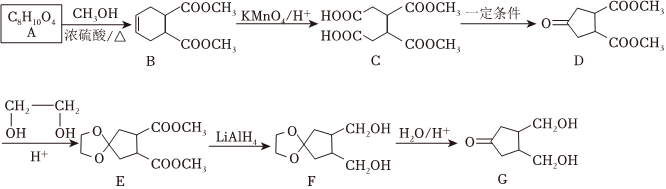
完成下列填空:
①C中含有的官能团名称为。G的分子式为。B→C的反应类型为。
②A→B的化学方程式为。
③写出满足下列条件的两种B的同分异构体。
i.分子中含有六元环;
ii.1mol能与2molNaHCO3反应;
iii.不同化学环境的氢原子个数比是3:2:1:1。
④设计反应D→E的目的是。
⑤参照上述合成路线,设计以 和1,3-丙二醇(HOCH2CH2CH2OH)为原料合成
和1,3-丙二醇(HOCH2CH2CH2OH)为原料合成 的合成路线 。(合成路线常用的表示方式为:甲乙••••••反应试剂反应条件目标产物)反应试剂反应条件组卷:28引用:1难度:0.5
的合成路线 。(合成路线常用的表示方式为:甲乙••••••反应试剂反应条件目标产物)反应试剂反应条件组卷:28引用:1难度:0.5
水溶液中的离子反应与平衡
-
5.(1)下列物质的水溶液因水解而呈碱性的是
。
A.Na2S
B.NH3
C.KOH
D.NH4Cl
(2)0.1mol•L-1的醋酸溶液中存在电离平衡:CH3COOH⇌CH3COO-+H+,要使溶液中值增大,可以采取的措施是c(H+)c(CH3COOH)。
①加少量烧碱固体
②升高温度
③加少量冰醋酸
④加水
A.②③
B.②④
C.①④
D.①③
(3)氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是。
A.1mol•L-1氢氰酸(HCN)溶液的pH约为3
B.HCN易溶于水
C.10mL1mol•L-1HCN恰好与10mL1mol•L-1NaOH溶液完全反应
D.HCN溶液的导电性比强酸溶液的弱
(4)溶液的pH与水的电离密切相关,以下说法一定正确的是。
A.90℃的纯水pH=7
B.将醋酸滴入氢氧化钠溶液,促进了水的电离
C.电解质溶液中都存在水的电离平衡
D.室温下pH相同的盐酸和明矾溶液,水的电离程度相同
(5)室温下,在10mL浓度均为0.1mol•L-1的醋酸和盐酸混合液中,滴加0.1mol•L-1的NaOH溶液VmL,则下列关系正确的是。
A.V=0时:c(H+)>c(Cl-)=c(CH3COOH)
B.V=10mL时:c(OH-)+c(CH3COO-)=c(H+)
C.V=20mL时:c(Na+)<c(CH3COO-)+c(Cl-)
D.加入NaOH溶液至pH=7时,V>20mL
(6)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题: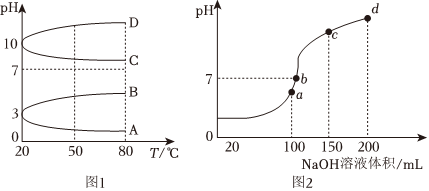
①相同条件下,0.1mol•L-1NH4Al(SO4)2溶液中的c()NH+4(填“等于”“大于”或“小于”)0.1mol•L-1NH4HSO4溶液中的c()。NH+4
②浓度均为0.1mol•L-1的几种电解质溶液的pH随温度变化的曲线如图1所示:
i.其中符合0.1mol•L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是,导致pH随温度变化的原因是。
ii.20℃时,0.1mol•L-1NH4Al(SO4)2溶液中2c()-c(SO2+4)-3c(A13+)=NH+4mol•L-1(填精确数值表达式)。
③室温时,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,溶液pH与NaOH溶液体积的关系如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是点;在b点,溶液中各离子浓度由大到小的排列顺序是。
④难溶电解质在水溶液中存在溶解平衡。25℃,某NH4Al(SO4)2溶液里c(A13+)=0.1mol•L-1,使Al3+开始沉淀的pH为。[25℃时,Al(OH)3的Ksp=1×10-34]
⑤向AgNO3溶液中加入过量NaCl溶液,会有白色沉淀产生,接着加入NaI溶液,发现白色沉淀变为黄色,请用平衡移动原理来解释颜色变化与溶液中c(Cl-)升高的原因:。组卷:86引用:1难度:0.5


