人教版(2019)选择性必修1《3.1 电离平衡》2023年同步练习卷(10)
发布:2024/8/16 16:0:2
一、选择题
-
1.电解质和非电解质是对化合物的一种分类方式.下列关于电解质的说法正确的是( )
组卷:238引用:15难度:0.9 -
2.下列说法正确的是( )
组卷:58引用:3难度:0.9 -
3.25℃时相同浓度的下列溶液中,导电能力最强的是( )
组卷:24引用:1难度:0.9 -
4.下列事实能说明醋酸是弱电解质的是( )
①醋酸与水能以任意比互溶;
②醋酸溶液能导电;
③醋酸溶液中存在醋酸分子;
④常温下,0.1mol/L醋酸的pH比0.1mol/L盐酸的pH大;
⑤醋酸能和碳酸钙反应放出CO2;
⑥pH=3的醋酸溶液加水稀释至原溶液体积的10倍后,pH<4;
⑦大小相同的铁片与同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢。组卷:64引用:3难度:0.5 -
5.下列关于强、弱电解质的叙述中正确的是( )
组卷:176引用:9难度:0.9 -
6.下列电离方程式中,正确的是( )
组卷:56引用:8难度:0.9 -
7.在氨水中,NH3•H2O电离达到平衡的标志是( )
组卷:72引用:3难度:0.9 -
8.如表是几种弱酸常温下的电离平衡常数,下列说法不正确的是( ):
CH3COOH H2CO3 H2S H3PO4 Ka=1.75×10-5 Ka1=4.5×10-7
Ka2=4.7×10-11Ka1=1.1×10-7
Ka2=1.3×10-13Ka1=6.9×10-3
Ka2=6.2×10-8
Ka3=4.8×10-13组卷:11引用:3难度:0.5
四、解答题
-
 23.硼酸(H3BO3)在食品、医药领域应用广泛.
23.硼酸(H3BO3)在食品、医药领域应用广泛.
(1)请完成B2H6气体与水反应的化学方程式:B2H6+6H2O=2H3BO3+.
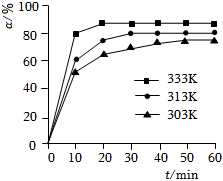
(2)在其他条件相同时,反应H3BO3+3CH3OH⇌B(OCH3)3+3H2O中,H3BO3的转化率(α)在不同温度下随反应时间(t)的变化如图,由此图可得出:
①温度对应该反应的反应速率和平衡移动的影响是.
②该反应的△H0(填“<”、“=”或“>”).
(3)H3BO3溶液中存在如下反应:
H3BO3(aq)+H2O(l)⇌[B(OH)4]-(aq)+H+(aq)已知0.70mol•L-1H3BO3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2.0×10-5mol•L-1,c平衡(H3BO3)≈c起始(H3BO3),水的电离可忽略不计,求此温度下该反应的平衡常数K=(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字).
(4)已知:25℃,H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11,则向饱和H3BO3溶液中滴加等浓度的Na2CO3溶液,现象为.组卷:10引用:2难度:0.3 -
24.砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一.
(1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有,其原因是CO2-3.
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图-1和图-2所示.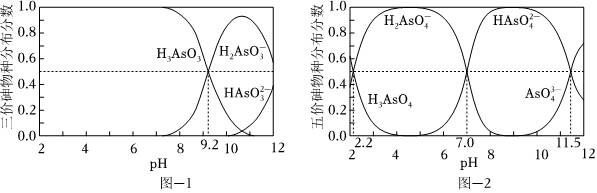
①以酚酞为指示剂(变色范围pH 8.0~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加.该过程中主要反应的离子方程式为.
②H3AsO4第一步电离方程式H3AsO4⇌H2+H+的电离常数为Ka1,则pKa1=AsO-4(p Ka1=-lg Ka1 ).
(3)溶液的pH对吸附剂X表面所带电荷有影响.pH=7.1时,吸附剂X表面不带电荷;pH>7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多.pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如图-3所示.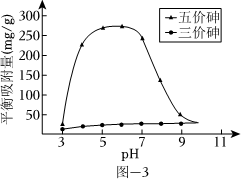
①在pH 7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是.
②在pH 4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为.提高吸附剂X对三价砷去除效果可采取的措施是.组卷:1320引用:11难度:0.3


