人教版(2019)选择性必修1《1.1 反应热》2023年同步练习卷(11)
发布:2024/8/16 21:0:1
一、选择题
-
1.下列热化学方程式或叙述正确的是( )
组卷:60引用:5难度:0.7 -
2.下列说法正确的是( )
组卷:5引用:2难度:0.5 -
3.根据图所得判断正确的是( )已知:H2O(g)═H2O(l)△H=-44 kJ/mol
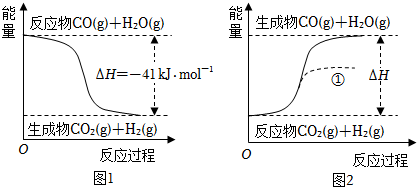 组卷:126引用:15难度:0.7
组卷:126引用:15难度:0.7 -
4.下列图示正确的是( )
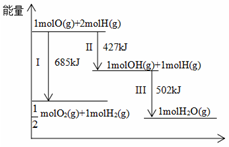 组卷:387引用:6难度:0.5
组卷:387引用:6难度:0.5 -
5.下列反应既属于氧化还原反应,又属于吸热反应的是( )
组卷:29引用:3难度:0.6 -
6.以NA代表阿伏加德罗常数的数值,则关于热化学方程式C2H2(g)+
O2(g)═2CO2(g)+H2O(l)△H=-1300kJ•mol-1的说法中,正确的是( )52组卷:6引用:9难度:0.8 -
7.关于反应能量的说法正确的是( )
组卷:10引用:3难度:0.5 -
8.已知在25℃、1.01×105 Pa下,1mol氢气在氧气中燃烧生成气态水的能量变化如图所示,下列有关说法正确的是( )
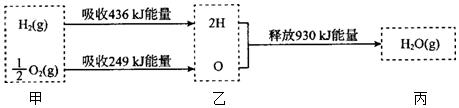 组卷:58引用:11难度:0.6
组卷:58引用:11难度:0.6
三、实验题
-
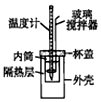 23.实验室用50mL 0.50mol/L盐酸、50mL 0.55mol/L NaOH溶液和如图所示装置进行中和热的测定实验,得到的数据如表所示。
23.实验室用50mL 0.50mol/L盐酸、50mL 0.55mol/L NaOH溶液和如图所示装置进行中和热的测定实验,得到的数据如表所示。
(1)经数据处理,t2-t1=3.4,则该实验测得的△H=实验次数 起始温度t1/℃ 终止温度t2/℃ 盐酸 NaOH溶液 1 20.2 20.3 23.7 2 20.3 20.5 23.8 3 21.5 21.6 24.9 。[溶液密度按1g/cm3计算,反应后混合溶液的比热容按4.18J/(g•℃)计算,结果保留三位有效数字]
(2)若用0.50mol/L盐酸与NaOH固体进行实验,则实验测得的反应热△H1(填“>”、“<”或“=”)△H。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得反应热为△H2,则△H2(填“>”、“<”或“=”)△H,理由是。组卷:4引用:2难度:0.6 -
 24.某实验小组用0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液进行中和热的测定。
24.某实验小组用0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液进行中和热的测定。
Ⅰ.配制0.50mol/L NaOH溶液
(1)实验中大约要使用245mL NaOH溶液,则至少需要称量NaOH固体g。
(2)配制NaOH溶液所需要的仪器:托盘天平、烧杯、玻璃棒、量筒、、
Ⅱ.测定中和热的实验装置如图所示。
(3)取50mL NaOH溶液和30mL H2SO4溶液进行实验,实验数据如表所示。
①使H2SO4溶液与NaOH溶液混合均匀的正确操作是实验次数 起始温度t1/℃ 终止温度
t2/℃温度差平均值
(t2-t1)/℃H2SO4溶液 NaOH溶液 平均值 1 27.0 27.4 27.2 31.2 2 25.9 25.9 25.9 31.5 3 26.4 26.2 26.3 30.5 。(填标号)
a.用温度计小心搅拌
b.揭开硬纸板用玻璃棒搅拌
c.轻轻地振荡烧杯
d.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
②填写表的空白。
③近似认为0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液的密度都是1g/cm3,中和后生成溶液的比热c=4.18J/(g•℃)。则中和反应的反应热△H=。(结果保留一位小数)
④上述实验测得结果大于理论值,产生偏差的原因可能是。(填标号)
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把溶液倒入盛有H2SO4溶液的小烧杯中
d.用温度计测定NaOH溶液的起始温度后直接测定H2SO4溶液的温度组卷:51引用:3难度:0.4


