2022-2023学年江苏省苏州市高二(下)期末化学试卷
发布:2024/8/4 8:0:9
一、单项选择题:共11小题,每题3分,共39分。每题只有一个选项最符合题意。
-
1.为应对全球气候变化,我国向世界承诺:2030年前达到“碳达峰”,2060年前实现“碳中和”,体现了大国担当。“碳中和”中的碳是指( )
组卷:21引用:2难度:0.5 -
2.反应NH4Cl+NaNO2═NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是( )
组卷:740引用:39难度:0.7 -
3.下列有关金属腐蚀的说法不正确的是( )
组卷:114引用:4难度:0.7 -
4.阅读下列资料,完成4~6题:氨是一种重要的化工原料,主要用于化肥工业,也广泛用于硝酸、纯碱、制药等工业;合成氨反应为N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1。实验室用加热NH4Cl和Ca(OH)2固体混合物的方法制取少量氨气。
实验室制取NH3时,下列装置能达到相应实验目的的是( )组卷:84引用:0难度:0.50 -
5.阅读下列资料,完成4~6题:氮及其化合物的转化具有重要应用。NH3是人工固氮的产物,广泛用于生产铵盐、硝酸、纯碱等;NH3能被NaClO氧化成N2H4⋅H2O(水合肼);NH3在一定条件下与CO2反应可制备尿素,尿素加热至150~160℃将脱氨成缩二脲。
下列有关氮及其化合物的说法正确的是( )组卷:30引用:0难度:0.70
二、非选择题:共4题,共61分。
-
16.H2S或水体中硫化物(H2S、HS-或S2-)的转化是资源利用和环境保护的重要研究课题。室温时,Ksp(CuS)=6.0×10-36,Ka1(H2S)=1.2×10-7,Ka2(H2S)=7.0×10-15。
(1)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。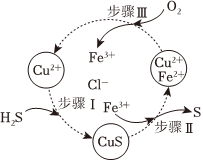
①步骤Ⅰ中发生反应:Cu2+(aq)+H2S(aq)═CuS(s)+2H+(aq),该反应的平衡常数K的数值为。
②步骤Ⅲ发生反应的离子方程式为。
③在温度一定和不补加溶液条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有。
(2)废水中的硫化物通常用氧化剂将其氧化为单质S进行回收。
①控制废水pH约为8,用适量30%的H2O2溶液将废水中的硫化物转化为单质S发生主要反应的离子方程式为。
②控制废水pH约为8,废水中单质硫回收率如图所示。H2O2溶液加入量大于12mg⋅L-1时,废水中单质硫的回收率下降的原因是。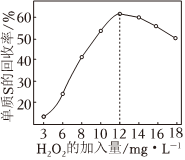
(3)为精确控制氧化剂的加入量,需对废水中硫化物含量进行测定。方法如下:
100.00mL水样H2足量水样稀H2SO4ZnSS(CH3COO)2ZnNaOH溶液S过量0.01000mol⋅L-1I2标准溶液
残留的I2溶液浓度用0.01000mol⋅L-1Na2S2O3溶液滴定,发生反应:I2+2S2═2I-+S4O2-3。补充完整测定残留I2溶液物质的量浓度的实验方案:向加入过量I2溶液后的锥形瓶中O2-6。组卷:81引用:1难度:0.5 -
17.电镀废水中的氰根(CN-)能抑制人体组织细胞内酶的活性,常采用电解法和氧化法转化为无毒物质后排放到环境中。
(1)电解法:用钛基二氧化铅涂层作阳极,不锈钢作阴极,电解含CN-电镀废水。
①若电镀废水呈碱性,阳极电极反应式为。
②处理低浓度含氰废水时,通常添加一定量的NaCl。电解相同时间,添加NaCl后CN-去除率明显提高,可能的原因是。
(2)氧化法:“臭氧-活性炭”去除CN-的机理如图所示(“*”表示活性炭表面吸附的物种;碱性条件下活性炭催化O3产生HO⋅)。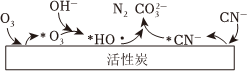
①HO⋅氧化CN-的离子方程式为。
②在含氰废水pH=8,臭氧通入量为25mg⋅min-1的实验条件下,1L含氰废水分别在“臭氧”、“活性炭”和“臭氧-活性炭”三种体系下对CN-的去除率随时间变化的曲线如图所示。“臭氧-活性炭”体系对CN-的去除率明显优于另外两个体系的原因是。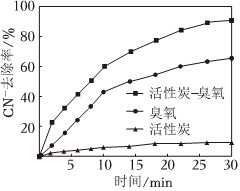
③调节废水pH=10,“臭氧-活性炭”体系对CN-的去除率增大的原因是。组卷:65引用:1难度:0.5


