人教版(2019)选择性必修1《第3章 水溶液中的离子反应与平衡》2023年单元测试卷(13)
发布:2024/8/16 5:0:1
一、选择题
-
1.《礼记•内则》记载:“冠带垢,和灰清漱;衣裳垢,和灰清浣。”古人洗涤衣裳冠带,所用的就是草木灰浸泡的溶液。下列说法错误的是( )
组卷:84引用:8难度:0.8 -
2.化学与生活密切相关,下列说法不正确的是( )
组卷:15引用:3难度:0.7 -
3.我国科学家研究表明α-甲基苄溴(
 ,Ph代表苯基)在NaOH水溶液中水解的反应历程如图所示,下列说法正确的是( )
,Ph代表苯基)在NaOH水溶液中水解的反应历程如图所示,下列说法正确的是( )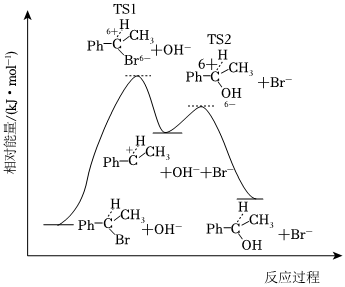 组卷:10引用:2难度:0.7
组卷:10引用:2难度:0.7 -
4.下列溶液的酸碱性及对应的解释均正确的是( )
选项 溶液 酸碱性 解释 A Fe2(SO4)3溶液 酸性 Fe3++3H2O⇌Fe(OH)3↓+3H+ B Na2S溶液 碱性 S2-+2H2O⇌H2S+2OH- C KHSO3溶液 酸性 HSO3-+H2O⇌H2SO3+OH- D NaHCO3溶液 碱性 HCO3-+H2O⇌H2CO3+OH- 组卷:21引用:4难度:0.8 -
5.下列叙述中正确的是( )
组卷:33引用:5难度:0.7 -
6.“酸碱质子理论”认为凡是能够给出质子(H+)的分子或离子都是酸,凡是能够接受质子的分子或离子都是碱.根据这一理论,下列微粒中既是酸又是碱的是( )
组卷:59引用:2难度:0.5
三、解答题
-
19.Ⅰ.已知常温时,Kw=1.0×10-14。现有常温下甲、乙、丙三种溶液,甲为0.01mol•L-1的NaOH溶液,乙为0.01mol•L-1的HCl溶液,丙为0.01mol•L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=。乙溶液的pH=。
(2)丙的水溶液中存在的所有电离平衡为,(用电离平衡方程式表示)。
(3)常温下,用水稀释0.01mol•L-1的CH3COOH溶液,下列各量随水量的增加而增大的是(填序号)。
①n(H+) ②c(H+) ③④c(OH-)•c(H+) ⑤c(CH3COOH)c(CH3COO-)c(OH-)c(H+)
Ⅱ.常温时,分别向20mL 0.1mol/LCH3COOH溶液和20mL 0.1mol/LHCl溶液中逐滴加入0.1mol/LNaOH溶液,其pH变化曲线如图所示(忽略温度变化)。
(4)CH3COOH~NaOH的滴定曲线中,d点溶液呈碱性的原因:(离子方程式表示),a、b、c、d四点对应的溶液中,水的电离程度由大到小的顺序为:。
(5)c点对应的溶液中各离子浓度的大小关系为:。
(6)a点对应的溶液中存在关系式:c(H+)+c(CH3COOH)-c(OH-)0.1mol/L(填“>”、“<”或“=”,下同),b点对应的溶液中:c(Na+)c(CH3COO-)。
(7)滴定HCl溶液时,pH的突变范围(比恰好中和时少滴或多滴1滴NaOH溶液,1滴溶液体积约0.04mL)为:。组卷:48引用:3难度:0.6 -
20.废弃电池随意丢弃会对土壤或水产生污染,电池中含有的重金属离子对植物生长有毒害作用,摄入人体
还会伤害人的脑细胞、神经、肝、肾、骨骼等等。某同学查阅一些难溶物常温下的溶度积常数如表:
(1)该同学在含有相同浓度Mn2+和Cu2+的溶液中滴加Na2S的稀溶液,观察到先出现的沉淀颜色是物质 FeS CuS(黑色) MnS(红色) PbS HgS ZnS Ksp 6.3×10-18 1.3×10-35 2.5×10-13 3.4×10-28 6.4×10-33 1.6×10-24 物质 Fe(OH)3 Al(OH)3 Mn(OH)2 Pb(OH)2 Zn(OH)2 Ksp 2.6×10-39 3.2×10-34 4.5×10-13 1.0×10-16 1.2×10-17 ,该实验说明在相同条件下Ksp越小,物质的溶解度(填“越大”或“越小”)。
(2)已知室温下铁离子开始沉淀的pH为1.0,则此溶液中 Fe3+的物质的量浓度为,若溶液中含有与Fe3+等浓度的 Al3+,调节 pH 使 Fe3+沉淀完全时,其中Al(OH)3沉淀(填“含有”或“不含有”)。
(3)某工业废水中含有Cu2+、Pb2+、Hg2+杂质,利用沉淀转化原理最适宜加入过量的(填序号)。
A.FeS B.Fe2O3 C.Na2S D.ZnO
写出加入该试剂除去Pb2+时发生的离子反应方程式。
(4)由 FeCl3•6H2O晶体得到纯的无水FeCl3,需要进行的操作是。组卷:70引用:4难度:0.7


