Ⅰ.已知常温时,Kw=1.0×10-14。现有常温下甲、乙、丙三种溶液,甲为0.01mol•L-1的NaOH溶液,乙为0.01mol•L-1的HCl溶液,丙为0.01mol•L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=1313。乙溶液的pH=22。
(2)丙的水溶液中存在的所有电离平衡为CH3COOH⇌CH3COO-+H+CH3COOH⇌CH3COO-+H+,H2O⇌OH-+H+H2O⇌OH-+H+(用电离平衡方程式表示)。
(3)常温下,用水稀释0.01mol•L-1的CH3COOH溶液,下列各量随水量的增加而增大的是①⑤①⑤(填序号)。
①n(H+) ②c(H+) ③c(CH3COOH)c(CH3COO-) ④c(OH-)•c(H+) ⑤c(OH-)c(H+)
Ⅱ.常温时,分别向20mL 0.1mol/LCH3COOH溶液和20mL 0.1mol/LHCl溶液中逐滴加入0.1mol/LNaOH溶液,其pH变化曲线如图所示(忽略温度变化)。

(4)CH3COOH~NaOH的滴定曲线中,d点溶液呈碱性的原因:CH3COO-+H2O⇌CH3COOH+OH-CH3COO-+H2O⇌CH3COOH+OH-(离子方程式表示),a、b、c、d四点对应的溶液中,水的电离程度由大到小的顺序为:d>c>b>ad>c>b>a。
(5)c点对应的溶液中各离子浓度的大小关系为:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)c(Na+)=c(CH3COO-)>c(H+)=c(OH-)。
(6)a点对应的溶液中存在关系式:c(H+)+c(CH3COOH)-c(OH-)==0.1mol/L(填“>”、“<”或“=”,下同),b点对应的溶液中:c(Na+)<<c(CH3COO-)。
(7)滴定HCl溶液时,pH的突变范围(比恰好中和时少滴或多滴1滴NaOH溶液,1滴溶液体积约0.04mL)为:4~104~10。
c
(
C
H
3
COOH
)
c
(
C
H
3
CO
O
-
)
c
(
O
H
-
)
c
(
H
+
)
【考点】酸碱混合时的定性判断及有关pH的计算.
【答案】13;2;CH3COOH⇌CH3COO-+H+;H2O⇌OH-+H+;①⑤;CH3COO-+H2O⇌CH3COOH+OH-;d>c>b>a;c(Na+)=c(CH3COO-)>c(H+)=c(OH-);=;<;4~10
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/16 5:0:1组卷:48引用:3难度:0.6
相似题
-
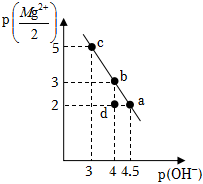 1.25℃时,向10mL0.05mol•L-1的MgCl2溶液中通入氨气,测得溶液中的p(OH-)与p()之间的变化曲线如图所示[已知:Kb(NH3•H2O)=1.0×10-5,p(X)=-lgc(X),忽略反应过程中溶液体积的变化]。下列说法正确的是( )Mg2+2发布:2024/12/30 4:0:1组卷:23引用:2难度:0.5
1.25℃时,向10mL0.05mol•L-1的MgCl2溶液中通入氨气,测得溶液中的p(OH-)与p()之间的变化曲线如图所示[已知:Kb(NH3•H2O)=1.0×10-5,p(X)=-lgc(X),忽略反应过程中溶液体积的变化]。下列说法正确的是( )Mg2+2发布:2024/12/30 4:0:1组卷:23引用:2难度:0.5 -
2.常温下,在体积均为20mL、浓度均为0.1mol/L的HX溶液、HY溶液中分别滴加0.1mol/L的NaOH溶液,反应后溶液中水电离的c(H+)的负对数[-lgc(H+)水]与滴加氢氧化钠溶液体积的关系如图所示。下列推断正确的是( )
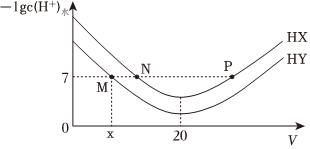 发布:2024/12/15 2:30:7组卷:71引用:4难度:0.6
发布:2024/12/15 2:30:7组卷:71引用:4难度:0.6 -
3.下列说法正确的是( )
发布:2025/1/1 8:0:2组卷:0引用:1难度:0.7


