2022-2023学年上海市华东师大二附中高一(下)期末化学试卷
发布:2024/8/31 1:0:8
Na及其化合物
-
1.钠元素在自然界中都以化合物的形式存在,如NaCl、Na2CO3等。钠的单质和化合物用途广泛。
(1)将金属钠溶于足量水,此过程中不存在。(不定项选择题)
A.金属键破坏
B.共价键断裂
C.离子键形成
D.共价键形成
(2)某溶液含有①、②NO-3、③HCO-3、④SO2-3、⑤CO2-3等五种负离子。向其中加入少量的Na2O2固体后,溶液中的离子浓度基本保持不变的是(忽略溶液体积变化)SO2-4。(单选)
A.①
B.①⑤
C.①④⑤
D.①③④⑤
纯碱(Na2CO3)和小苏打(NaHCO3)都是白色晶体,在日常生活中都可以找到。
(3)若要在实验室中将它们区分开来,下列方法中可行的是。(单选)
A.在烧杯中各盛相同质量的样品,分别加入等体积等浓度的盐酸,观察反应的剧烈程度
B.分别用干净铁丝蘸取样品在酒精灯的火焰上灼烧,观察火焰颜色
C.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀
D.分别放在坩埚中加热灼烧,观察是否有残留物
化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,其生产流程可简要表示如图: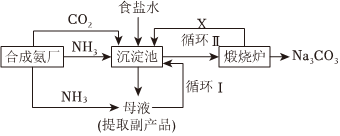
(4)往饱和食盐水中依次通入足量的NH3、CO2,而不先通CO2再通NH3的原因是。
(5)物质X是(填化学式)。
(6)写出沉淀池中反应的化学方程式:。组卷:180引用:1难度:0.2
硫酸亚铁铵
-
2.硫酸亚铁铵俗称莫尔盐,为浅绿色晶体,它在空气中比一般的亚铁盐要稳定,不易放氧化,易溶于水,但不溶于乙醇。
某小组同学设计如下实验制备莫尔盐:
步骤1:铁屑的净化
称取铁屑,放入锥形瓶中,加入10%Na2CO3溶液,缓缓加热约10min,除去碱液,用水清洗铁屑。
步骤2:硫酸亚铁的制备
向盛有铁屑的锥形瓶中加入3mol/LH2SO4溶液,加热,直至反应基本完成,制得硫酸亚铁溶液。
步骤3:硫酸亚铁铵的制备
向上述溶液中加入(NH4)2SO4固体制得混合溶液,“操作X”,冷却至室温析出硫酸亚铁铵晶体,过滤。
(1)步骤2为加快反应速率,需将试剂温度保持在70~75℃,一般采取的加热方式是。
(2)步骤3中,“操作X”为。
(3)配制步骤2所需溶液的蒸馏水,需经煮沸并迅速冷却后再使用,目的是。
(4)本实验制得的硫酸亚铁铵晶体常含有Fe3+杂质.检验步骤2所得溶液中是否有Fe3+常用的试剂是,可以观察到的现象是。
实验小组为测定莫尔盐[(NH4)2Fe(SO4)2⋅nH2O]的化学式,操作过程如下:
①称取质量为196g的莫尔盘,制成溶液v。
②加入含0.001molKMnO4的酸性溶液,一段时间后,恰好完全被Fe2+还原为Mn2+.Fe2+恰好完全被MnO-4氧化为Fe3+。MnO-4
(5)通过计算得出n=。组卷:29引用:1难度:0.5
化学反应速率
-
5.某实验小组为探究外界条件对化学反应速率的影响进行如下实验:
实验1:探究常温下影响等质量金属与酸反应生成氢气速率的因素:
(1)实验Ⅰ、Ⅱ探究的是实验编号 金属 c(酸)/(mol⋅L-1) 溶液体积/mL Ⅰ 铁粉 2mol⋅L-1硫酸 10 Ⅱ 铁粉 2mol⋅L-1盐酸 10 Ⅲ 铁块 2mol⋅L-1硫酸 10 对反应速率的影响。
(2)实验Ⅰ、Ⅲ及相应实验现象得到的结论是。
(3)甲同学在进行实验Ⅲ时又加入了少量硫酸铜固体,发现生成气体速率明显加快,试分析其原因:。
实验2:探究影响反应+3ClO-3=Cl-+3HSO-3+3H-的因素。SO2-4
(4)表中a=实验编号 0.1mol⋅L-1KClO3溶液的体积mL 0.3mol⋅L-1NaHSO3溶液的体积mL 水的体积/mL 反应温度 Ⅳ 10 10 0 25℃ Ⅴ 10 5 a 25℃ Ⅵ 10 10 0 60℃ 。
(5)通过实验Ⅳ和实验Ⅵ可探究对化学反应速率的影响。
该小组同学依据实Ⅴ条件进行反应并测定其化学反应速率,所得数据如图所示。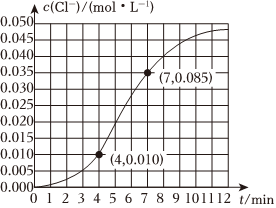
(6)内用表示的平均反应速率为HSO-3mol⋅L-1⋅min-1。组卷:67引用:1难度:0.5
化学平衡
-
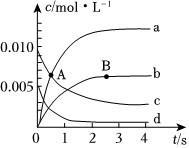 6.800℃时,在2L密闭容器中,发生反应2NO(g)+O2(g)⇌2NO2(g),体系中,n(NO)随时间的变化如下表所示。
6.800℃时,在2L密闭容器中,发生反应2NO(g)+O2(g)⇌2NO2(g),体系中,n(NO)随时间的变化如下表所示。
(1)图中表示NO2变化的曲线是时间/s 0 1 2 3 4 5 n(NO)/mol 0.020 0.010 0.008 0.007 0.007 0.007 ,图中A点处v正v逆(选填“大于”“小于”或“等于”)。
(2)下列不能说明该反应已经达到平衡状态的是。(不定项选择题)
A.容器内的压强不随时间改变
B.容器内颜色保持不变
C.2v逆(NO)=v正(O2)
D.容器中气体的平均相对分子质量不随时间改变
(3)下列能使该反应的反应速率增大的是。(不定项选择题)
A.及时分离出NO2气体
B.适当升高温度
C.缩小容器体积增大压强
D.选择高效的催化剂
氢气是重要的工业原料,煤的气化是一种重要的制氢途径.反应过程如下:
①C(s)+H2O(g)⇌CO(g)+H2(g)ΔH=131.4kJ⋅mol-1
②CO(g)+H2O(g)⇌CO2(g)+H2(g)ΔH=-41.1kJ⋅mol-1
在一定温度下,向体积固定的密闭容器中加入足量C(s)和1molH2O(g)。反应平衡时,H2O(g)的物质的量为0.5mol,CO的物质的量为0.1mol。
(4)下列说法正确的是。(双选)
A.将炭块粉碎,可加快反应速率
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时H2的体积分数可能大于23
(5)若平衡时向容器中充入惰性气体,容器内总压强(选填“增大”“减小”或“不变”),反应①的v正,v逆(选填“增大”“减小”或“不变”)。
(6)达到平衡时,整个体系(选填“吸收”或“放出”)热量kJ。组卷:56引用:1难度:0.5


