2023-2024学年安徽省合肥市六校联盟高二(上)期中化学试卷
发布:2024/10/19 16:0:6
一、选择题(本大题共14小题,每小题4分,共56分,每小题只有一个正确答案,请把正确答案涂在答题卡上)
-
1.下列关于热化学方程式的叙述错误的是( )
组卷:22引用:1难度:0.7 -
2.下列示意图与化学用语表述内容不相符的是( )(水合离子用相应离子符号表示)
A B C D 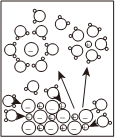
NaCl溶于水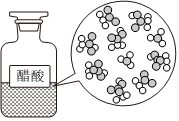
CH3COOH在水中电离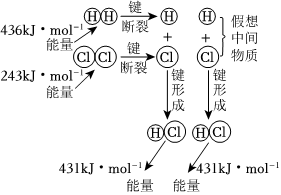
H2与Cl2反应能量变化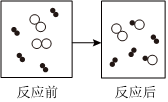
H2和I2加热到一定温度反应NaCl=Na++Cl- CH3COOH⇌CH3COO-+H+ H2(g)+Cl2(g)=2HCl(g)ΔH=-183kJ•mol-1 H2+I2 2HI△组卷:18引用:3难度:0.8 -
3.下列事实不能说明NH3•H2O是弱电解质的是( )
组卷:23引用:5难度:0.6 -
4.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)⇌zC(g),达到平衡时,测得A的浓度为0.5mol•L-1,在温度不变的条件下,将容器的体积扩大到两倍,再达到平衡,测得A的浓度降低为0.3mol•L-1。下列有关判断正确的是( )
组卷:42引用:9难度:0.7 -
5.用稀盐酸与稀NaOH溶液(碱稍过量)测定中和反应的反应热时,下列有关说法错误的是( )
组卷:18引用:3难度:0.8 -
6.二氧化硫的催化氧化反应:2SO2(g)+O2(g)⇌2SO3(g)是工业制硫酸的重要反应之一。下列说法错误的是( )
组卷:25引用:4难度:0.5
二、填空题(本大题共4题,共44分,请把答案写在答题卡指定位置)
-
17.将浓度均为0.01 mol/L 的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
【资料】
该“碘钟实验”的总反应:H2O2 +2S2O32-+2H+═S4O62-+2H2O
反应分两步进行:
反应A:H2O2 +2I-+2H+═I2+2H2O
反应B:……
(1)反应B的离子方程式是。对于总反应,I-的作用相当于。
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
试剂X是。
试剂
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ。
(溶液浓度均为0.01 mol/L)
溶液从混合时的无色变为蓝色的时间:实验Ⅱ是30 min、实验Ⅲ是40 min。用量(ML)
序号H2O2
溶液H2SO4
溶液Na2S2O3
溶液KI溶液
(含淀粉)
H2O实验Ⅱ 5 4 8 3 0 实验Ⅲ 5 2 x y z
①实验Ⅲ中,x、y、z所对应的数值分别是。
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验Ⅳ.(溶液浓度均为0.01 mol/L)
实验过程中,溶液始终无明显颜色变化。用量(mL)
号
试剂H2O2
溶液H2SO4
溶液Na2S2O3
溶液KI溶液(含淀粉)
H2O实验Ⅳ 4 4 9 3 0
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验Ⅳ未产生颜色变化的原因:。组卷:142引用:17难度:0.5 -
18.硫酸在工业生产中有着重要的意义,SO2是工业制硫酸的重要原料。
(1)T℃时,向2.0L的恒容密闭容器中充入1.0molSO2和0.6molO2,发生如下反应:2SO2(g)+O2(g)⇌2SO3(g),20s后反应达到平衡,c(SO2)和c(O2)相等,v(SO2)=mol•L-1•s-1,平衡后向容器中再充入0.4molSO3和0.3molO2,此时,v(正)v(逆)。(填“>”、“=”或“<”)
(2)在1L的密闭容器中,加入足量的焦炭和1molSO2反应,C(s)+2SO2(g)⇌2CO2(g)+S2(g)。
①反应在某温度达到平衡时,SO2和CO2的体积分数都等于40%,该温度下的平衡常数K=。
②按相同投料方式发生上述反应,相同时间内测得SO2与S2的生成速率随温度变化的关系如图1所示。其它条件相同时,在不同催化剂作用下,SO2转化率与温度关系如图2所示。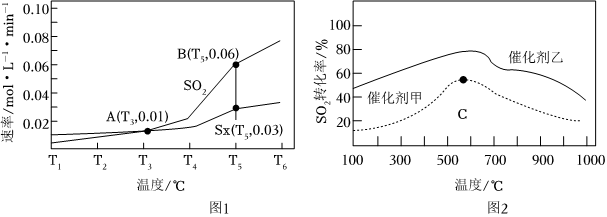
700℃时,催化剂(填“甲”或“乙”)活性更高,A、B、C三点对应的反应状态中,达到平衡状态的是(填字母)。组卷:9引用:1难度:0.5


