2021-2022学年河南省驻马店市新蔡第一高级中学高三(上)月考化学试卷(11月份)
发布:2024/9/12 9:0:8
一、选择题(共12小题,每小题0分,满分0分)
-
1.设NA是阿伏加德罗常数的值,下列说法正确的是( )
组卷:2引用:4难度:0.6 -
2.“辛勤的劳动才能创造美好的生活”。下列生产活动中,没有运用相应化学原理的是( )
选项 生产活动 化学原理 A 古代科技:我国古代湿法炼铜 发生置换反应 B 现代建筑:港珠澳大桥的钢铁护栏涂刷防锈漆 钢铁与潮湿空气隔绝可防止腐蚀 C 科学研究:屠呦呦从青蒿中提取青蒿素 主要利用蒸馏原理 D 民间艺术:五颜六色的烟花 金属和金属离子的焰色反应 组卷:6引用:2难度:0.5 -
3.常温下,下列各组离子在给定溶液中能大量共存的是( )
组卷:19引用:3难度:0.7 -
4.下列实验操作能达到实验目的的是( )
实验目的 实验操作 A. 制备Fe(OH)3胶体 将NaOH浓溶液滴加到饱和FeCl3溶液中 B. 由MgCl2溶液制备无水MgCl2 将MgCl2溶液加热蒸干 C. 除去Cu粉中混有的CuO 加入稀硝酸溶液,过滤、洗涤、干燥 D. 比较水与乙醇中氢的活泼性 分别将少量钠投入到盛有水和乙醇的烧杯中 组卷:248引用:29难度:0.7 -
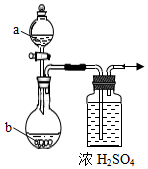 5.用如图装置制取干燥的气体(a、b表示加入的试剂),能实现的是( )
5.用如图装置制取干燥的气体(a、b表示加入的试剂),能实现的是( )选项 气体 a b A H2S 稀H2SO4 FeS B O2 H2O2溶液 MnO2 C NO2 浓HNO3 铁片 D NH3 浓氨水 CaO 组卷:432引用:7难度:0.5
二、解答题(共3小题,满分0分)
-
14.铁及其化合物在日常生活生产中应用广泛,研究铁及其化合物的应用意义重大。回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH1
Fe2O3(s)+CO(g)=13Fe3O4(s)+23CO2(g) ΔH213
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) ΔH3
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH4
则ΔH4的表达式为ΔH4=(用含ΔH1、ΔH2、ΔH3的代数式表示)。
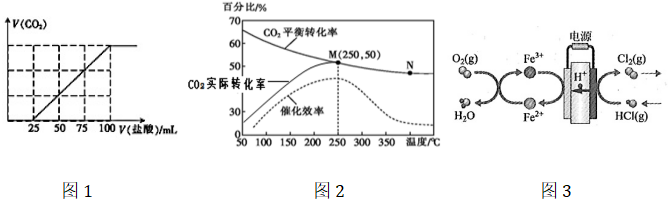
(2)把高炉出来的气体经过处理后通入NaOH溶液中完全吸收,再用0.01mol•L-1的盐酸溶液进行滴定,所得气体与滴入的盐酸体积的关系如图1,则滴定前溶液中离子浓度由大到小的顺序为:。
(3)铁等金属可用作CO与氢气反应的催化剂。已知某种催化剂可用来催化反应CO(g)+3H2(g)⇌CH4(g)+H2O(g) ΔH<0。在T℃、106Pa时将1molCO和3molH2加入容积不变的密闭容器中,实验测得CO的体积分数φ(CO)如下表:
①能判断反应CO(g)+3H2(g)⇌CH4(g)+H2O(g)达到平衡的是t/min 0 10 20 30 40 50 φ(CO) 0.25 0.23 0.214 0.202 0.200 0.200 (填字母)。
a.容器内压强不再发生变化
b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2)
d.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO的转化率为。
③某种含铁催化剂可以催化合成乙烯:6H2(g)+2CO2(g)⇌CH2=CH2(g)+4H2O(g)。已知温度对CO2的平衡转化率、实际催化率和催化剂催化效率的影响如图2所示,结合图像分析温度低于250℃时CO2实际转化率变化的原因:。
(4)科学家最近采用碳基电极材料,在传统的电解氯化氢回收氯气技术的基础上,设计了一种新的工艺方案,主要包括电化学过程和化学过程,如图3所示.负极区发生的反应有Fe3++e−=Fe2+、(写反应方程式)。组卷:21引用:3难度:0.7 -
 15.KMnO4是一种高效氧化剂,可用来氧化吸附有机异味物,也可以与水中的杂质如二价铁、锰、硫、氰、酚等反应。实验室常用Na2C2O4标准溶液标定未知浓度的KMnO4溶液,发生反应:5C2+2O2-4+16H++4H2O═2【Mn(H2O)6】2++10CO ↑ 。MnO-4
15.KMnO4是一种高效氧化剂,可用来氧化吸附有机异味物,也可以与水中的杂质如二价铁、锰、硫、氰、酚等反应。实验室常用Na2C2O4标准溶液标定未知浓度的KMnO4溶液,发生反应:5C2+2O2-4+16H++4H2O═2【Mn(H2O)6】2++10CO ↑ 。MnO-4
根据以上信息,完成下列问题:
(1)按电子排布K位于元素周期表的区,基态Mn2+的核外电子排布式可表示为。
(2)1mol【Mn(H2O)6]2+中所含有的共价键数目为。
(3)基态C原子的核外电子中占据最高能级的电子云轮廓图为C2中碳原子的轨道杂化类型是O2-4。
(4)同主族元素氧、硫、硒对应最简单氢化物的沸点:H2O>H2Se>H2S,原因是。
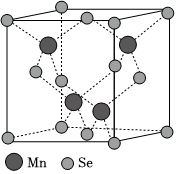
(5)β-MnSe的结构中Se为面心立方最密堆积,晶胞结构如图所示。
①β-MnSe中Mn的配位数为。
②若该晶体的晶胞参数为apm,阿伏加德罗常数的值为NA.β-MnSe的密度ρ=(列出表达式)g•cm-3。组卷:17引用:1难度:0.7


