2022-2023学年江苏省南京市宁海中学高二(下)期末化学试卷
发布:2024/5/26 8:0:9
一.单项选择题(共11小题,每题3分,共39分)
-
1.11月12日天舟五号货运飞船与中国空间站天和核心舱后向端口成功交会对接。下列有关空间站说法不正确的是( )
组卷:76引用:5难度:0.7 -
2.反应PH3+HCl+4HCHO═[P(CH2OH)4]Cl的产物常被用作棉织物的防火剂。下列表示反应中相关微粒的化学用语正确的是( )
组卷:74引用:5难度:0.8 -
3.黑火药是中国古代四大发明之一,其爆炸反应为2KNO3+S+3C═K2S+N2↑+3CO2↑。下列说法正确的是( )
组卷:65引用:3难度:0.7 -
4.阅读下列资料,完成题:氨气是一种重要的化工原料,以氨为原料可以生产化肥和硝酸,在催化剂条件下,氨催化氧化生成NO,进而继续被氧化为NO2,再与水反应生成硝酸,氨气与硝酸反应可得氮肥硝酸铵。实验室制备、干燥、收集 NH3并进行尾气处理,下列装置能达到实验目的的是( )
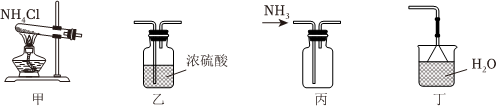 组卷:16引用:1难度:0.5
组卷:16引用:1难度:0.5 -
5.阅读下列材料,完成5~7题:氯及其化合物应用广泛,Cl2可用于制次氯酸、消毒液、漂白粉,在碱性条件下与Fe(OH)3反应可制取水处理剂高铁酸钾(K2FeO4),K2FeO4能与水反应生成气体和Fe(OH)3胶体;硫酰氯(SO2Cl2)是生产医药、农药的重要原料,在催化剂作用下合成反应为SO2(g)+Cl2(g)⇌SO2Cl2(g)ΔH=akJ⋅mol-1(a<0)。NH4ClO4可用作火箭推进剂。
在给定条件下,下列选项所示的物质间转化能实现的是( )组卷:33引用:0难度:0.70
二.非选择题(共4小题,共61分)
-
16.Cr(OH)3常用于颜料、陶瓷、橡胶等工业。实验室模拟工业上以BaCrO4为原料制备Cr(OH)3的主要步骤如下。
(1)制备CrCl3。取一定质量的BaCrO4和对应量的水加入到如图所示三颈瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成CrCl3并逸出CO2气体。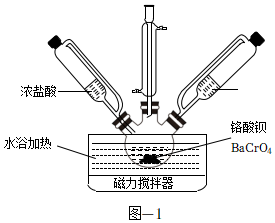
①上述反应的化学方程式为。
②在盐酸与BaCrO4物料配比6:1、80℃条件下搅拌,反应30min。探究乙醇理论量倍数对铬溶解率及还原率的影响如图所示[铬溶解率=×100%,铬还原率=溶液中n(Cr总量)n(BaCrO4)×100%]。随着乙醇理论量倍数的增加,铬还原率逐渐增加、铬溶解率几乎不变,其原因可能是溶液中n[Cr(III)]n(BaCrO4)。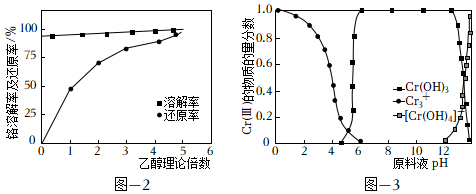
(2)制备Cr(OH)3。Cr(III)的存在形态的物质的量分数随溶液pH的分布如图所示。请补充完整由步骤(1)得到的CrCl3溶液制得Cr(OH)3的实验方案:取步骤(1)得到的CrCl3溶液,,低温烘干,得到Cr(OH)3晶体。实验中须使用的试剂:2mol•L-1Ba(OH)2溶液、0.1mol•L-1AgNO溶液、0.1mol•L-1HNO3溶液、蒸馏水。
(3)测定Cr(OH)3样品纯度。准确称取0.9000g样品,溶于过量硫酸并配成250.0mL溶液。取25.00mL溶液,用足量(NH4)2S2O8溶液将Cr3+氧化为Cr2O72-,煮沸除去过量的(NH4)2S2O8,冷却至室温。再加入过量KI溶液,以淀粉溶液为指示剂,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液24.00mL(已知反应:Cr2O72-+6I-+14H+=3I2+2Cr3++7H2O;I2+2S2O32-=S4O62-+2I-)。计算Cr(OH)3样品的纯度(写出计算过程):。组卷:116引用:3难度:0.5 -
17.页岩气中含有CH4、CO2、H2S等气体,是蕴藏于页岩层可供开采的天然气资源。页岩气的有效利用需要处理其中所含的CO2和H2S。
Ⅰ.CO2的处理:
(1)CO2和CH4重整可制合成气(主要成分为CO、H2)。已知下列热化学反应方程式:
C(s)+2H2(g)═CH4(g);ΔH=-74.5kJ•mol-1
CO(g)+H2O(g)═CO2(g)+H2(g);ΔH=-40.0kJ•mol-1
C(s)+H2O(g)═CO(g)+H2(g);ΔH=+132.0kJ•mol-1
反应CO2(g)+CH4(g)═2CO(g)+2H2(g)的ΔH=kJ•mol-1。
(2)Ni催化CO2加H2形成CH4,其历程如图1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中CH4的百分含量及CO2的转化率随温度的变化如图2所示。
①260℃时生成主要产物所发生反应的化学方程式为。
②温度高于320℃,CO2的转化率下降的原因是。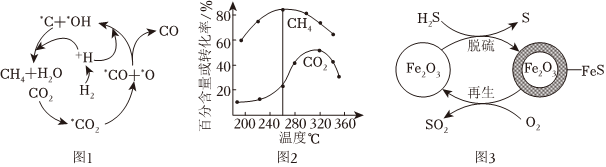
Ⅱ.H2S的处理:Fe2O3可用作脱除H2S气体的脱硫剂。Fe2O3脱硫和Fe2O3再生的可能反应机理如图3所示。
(3)Fe2O3脱硫剂的脱硫和再生过程可以描述为。
(4)再生时需控制通入O2的浓度和温度。400℃条件下,氧气浓度较大时,会出现脱硫剂再生时质量增大,且所得再生脱硫剂脱硫效果差,原因是。
(5)脱硫剂再生时可以使用水汽代替O2。700℃条件下,用水汽代替O2再生时,生成Fe3O4、H2S和H2,Fe3O4也可作脱硫剂。
①写出水汽作用条件下脱硫剂再生反应的化学方程式:。
②用O2再生时会生成污染性气体SO2,用水汽再生时会排放出有毒的H2S,采用O2和水汽混合再生的方法,可以将产生的SO2和H2S转化为S单质。则为不排放出SO2和H2S,理论上O2和水汽的体积比应为。组卷:139引用:6难度:0.6


