2021-2022学年河南省驻马店市确山第二高级中学高三(上)期中化学试卷
发布:2024/8/6 8:0:9
一、选择题:(本题共20小题,1-15小题,每小题2分,16-20小题,每小题2分,共45分)
-
1.化学与生产、生活、社会密切相关,下列有关说法中正确的是( )
组卷:0引用:2难度:0.7 -
2.下列有关非金属元素说法正确的是( )
组卷:9引用:2难度:0.7 -
3.下列对物质的主要用途、原因解释的描述都正确的是( )
选项 物质 主要用途 原因解释 A 晶体硅 高纯硅可用于制备光导纤维、光电池、集成电路和计算机芯片 硅是良好的半导体材料 B 金属铝 高铁车厢采用铝合金材料 铝与氧气不反应 C 氯气 与石灰乳或烧碱反应制备消毒剂 氯气有强氧化性 D 金属钠 高温时能从熔融TiCl4中置换出金属Ti 钠具有很强的还原性 组卷:16引用:6难度:0.7 -
4.铁及其化合物是中学化学中的一类重要物质,下列关于铁元素的叙述中正确的是( )
组卷:7引用:1难度:0.5 -
5.已知4NH3(g)+5O2(g)═4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为( )
组卷:93引用:12难度:0.7 -
6.废气中的H2S通过高温热分解可制取氢气:2H2S(g)⇌2H2(g)+S2(g),某温度时,下列不能够说明H2S的转化率达到最大值的依据是( )
组卷:0引用:1难度:0.6 -
7.250℃,101Kpa时,2N2O5(g)=4NO2(g)+O2(g)△H=+56.76kJ/mol,该反应能自发进行,其自发进行的主要原因是( )
组卷:165引用:13难度:0.9 -
8.相同温度下,根据三种酸的电离常数,下列判断正确的是( )
酸 HX HY HZ 电离常数K/(mol•L-1) 9×10-7 9×10-6 1×10-2 组卷:109引用:12难度:0.5
二、非选择题(本题共4小题,共55分)
-
23.三氯化六氨合钴(Ⅲ)([Co(NH3)6]Cl3,钴为+3价)在钴化合物的合成中是重要原料。实验室以CoCl2为原料制备[Co(NH3)6]Cl3,步骤如下:
Ⅰ.CoCl2的制备。
CoCl2可以通过钴和氯气反应制得,实验室制备纯净CoCl2可用如图实验装置实现(已知:钴单质在300℃以上易被氧气氧化,CoCl2易潮解)。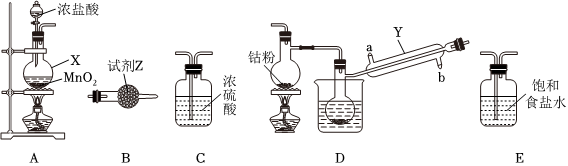
(1)仪器X的名称为。
(2)X中发生反应的离子方程式为。
(3)装置的连接顺序为A→→B。
Ⅱ.[Co(NH3)6]Cl3的制备。
在100mL锥形瓶内加入4.5g研细的二氯化钴CoCl2,3gNH4Cl和5mL水,加热溶解后加入0.3g活性炭作催化剂,冷却后,通入足量NH3,混合均匀;控制温度在10℃以下,缓慢加入10mL10%的H2O2,然后加热至60℃左右,恒温20分钟,适当摇动锥形瓶:在冰水中冷却所得溶液,即有晶体析出(粗产品)。回答下列问题:
(4)该过程中控制温度为60℃的方法是。
(5)制备[Co(NH3)6]Cl3的总反应化学方程式为。
Ⅲ.测定[Co(NH3)6]Cl3中钴的含量。
(6)原理:利用Co3+将KI氧化成I2,Co3+被还原后的产物为Co2+。然后用0.015mol•L-1Na2S2O3标准溶液滴定生成的I2,Na2S2O3所得产物为S4。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。则该氧化还原滴定指示剂为O2-6,该样品中钴元素的质量分数为。组卷:10引用:4难度:0.5 -
 24.以黄铜矿(主要成分为铁、铜、硫三种元素组成的化合物)为基本原料,通过一系列的冶炼可得到铜、铁、SO2、SO3、H2SO4等物质,回答下列问题:
24.以黄铜矿(主要成分为铁、铜、硫三种元素组成的化合物)为基本原料,通过一系列的冶炼可得到铜、铁、SO2、SO3、H2SO4等物质,回答下列问题:
(1)基态铁原子价层电子排布式为,基态硫原子的核外电子共有种不同的能量。硫元素所在周期的非金属元素第一电离能由大到小的顺序为。
(2)SO2、SO3、H2SO4中,硫原子的杂化轨道类型为sp3的物质是,SO2的分子构型是,属于非极性分子的氧化物是。
(3)在溶液中Cu2+易与水形成[Cu(H2O)6]2+而显蓝色,向相应的溶液中加入足量的氨水可得到[Cu(NH3)4(H2O)2]2+,则[Cu(NH3)4(H2O)2]2+中Cu2+的配位数是,氧铜配位键与氮铜配位键相比,较稳定的是。
(4)氧化铜的熔点为1326℃、沸点为1800℃;氧化亚铜的熔点为1235℃、沸点为1100℃,试解释导致这种差异最可能的原因是。
(5)由铁、铜、硫形成的某种化合物的晶胞是一个长方体,结构如图所示,则该化合物的化学式为。若晶体密度为dg•cm-3,则晶胞的高h=pm(写出简化后的计算式即可)。组卷:19引用:2难度:0.6


