2022-2023学年浙江省嘉兴市高二(上)期末化学试卷
发布:2024/9/8 0:0:9
一、选择题(每小题只有一个选项符合题意,每小题2分,共50分)
-
1.影响化学反应速率的主要因素是( )
组卷:34引用:1难度:0.7 -
2.下列微粒能促进水的电离的是( )
组卷:34引用:1难度:0.7 -
3.下列电离方程式正确的是( )
组卷:33引用:1难度:0.5 -
4.恒容密闭容器中,A与B反应生成C,其化学反应速率分别用v(A)、v(B)、v(C)表示。已知:3v(B)=2v(A),3v(B)=2v(C),则此反应可表示为( )
组卷:31引用:1难度:0.5 -
5.一定条件下,密闭容器中发生反应:C2H6(g)⇌C2H4(g)+H2(g)ΔH>0。达到平衡后,下列措施不能提高乙烷平衡转化率的是( )
组卷:83引用:3难度:0.5 -
6.冰融化成水的过程中,其焓变和熵变正确的是( )
组卷:22引用:13难度:0.8 -
7.采取下列措施对增大化学反应速率有明显效果的是( )
组卷:34引用:1难度:0.5 -
8.常温下,向50mL0.1mol/LHNO3溶液中加入25mL0.1mol/LBa(OH)2溶液,所得溶液呈( )
组卷:35引用:1难度:0.5 -
9.向10mL0.1mol/L的醋酸溶液中加蒸馏水,将其稀释到1L,下列说法中不正确的是( )
组卷:90引用:1难度:0.6 -
10.等体积、等物质的量浓度的弱碱MOH溶液和强酸HA溶液混合后,溶液中有关离子浓度大小关系正确的是( )
组卷:186引用:1难度:0.5
二、填空题(本题有5小题,共50分)
-
29.汽车尾气中的氮的氧化物会造成严重的大气污染,某研究小组拟利用氢气还原法降低空气中NO的含量。
Ⅰ.已知:2NO(g)+2H2(g)⇌N2(g)+2H2O(g),该自发反应包括两个基元反应:
a.2NO(g)+H2(g)⇌N2(g)+H2O2(l)(慢)
b.H2(g)+H2O2(l)⇌2H2O(g)(快)
(1)总反应的ΔS0(填“>”、“<”或“=”);基元反应a的化学平衡常数表达式为。
(2)2H2O2(l)═2H2O(l)+O2(g)ΔH=-196.46kJ•mol-1;
H2(g)+O2(g)═H2O(g)ΔH=-241.84kJ•mol-1;12
H2O(l)═H2O(g)ΔH=44kJ•mol-1
则基元反应b的ΔH=kJ•mol-1。
(3)画出上述过程的能量变化与反应历程关系图。
(4)总反应的速率表达式为v=kcm(NO)cn(H2)(k为速率常数,只与温度有关),T℃时测得以下数据。
下列说法错误的是序号 c(NO)/mol•L-1 c(H2)/mol•L-1 速率/mol•(L•min)-1 ① 0.0060 0.0010 1.8×10-4 ② 0.0060 0.0020 3.6×10-4 ③ 0.0010 0.0060 3.0×10-5 ④ 0.0020 0.0060 1.2×10-4 。
A.其他条件不变,压缩实验②的容器体积,其反应速率和平衡常数均增大
B.该反应的速率表达式为v=5000c2(NO)c(H2)
C.NO和H2的键能之和大于N2和H2O的键能之和
D.恒温恒压条件下实验④达到平衡后,再向其中加入一定量水蒸气,平衡逆向移动,总反应速率增大
Ⅱ.研究表明0.5%Pt/ZSM-35催化剂能在有氧条件下提高氢气还原NO的总反应速率。已知有氧条件下NO-O2-H2体系中除Ⅰ的总反应外,还存在以下三个竞争反应:
2NO(g)+O2(g)+4H2(g)⇌N2(g)+4H2O(g);
2NO(g)+O2(g)+3H2(g)⇌N2O(g)+3H2O(g);
O2(g)+2H2(g)⇌2H2O(g)。
氧气体积分数对NO平衡转化率和N2产率的影响见图1和图2。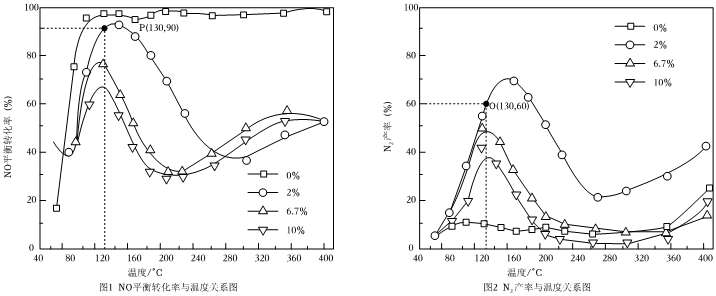
(5)若向130℃、容积为1L的密闭容器内加入1.6molNO和适量的H2、O2(其中氧气体积分数2%),反应达到平衡后N2O的物质的量为mol(假设体系内仅存在NO和N2O两种含氮化合物)。
(6)据图分析:反应选择130~160℃、投入2%氧气为适宜条件的依据是。组卷:22引用:1难度:0.4 -
30.废旧铅蓄电池的铅膏中主要含有PbSO4、PbO2、PbO和Pb。还有少量Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,某研究小组设计如图流程实现铅的回收。
查阅资料: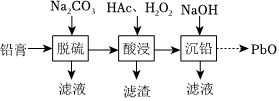
i.溶度积常数:Ksp(PbSO4)=2.5×10-8;Ksp(PbCO3)=7.4×10-14;
ii.一定条件下,金属离子开始沉淀和完全沉淀时的pH如下:
iii.NaHCO3溶液遇酚酞试剂不显色Fe3+ Fe2+ Al3+ Pb2+ 开始沉淀时 2.3 6.8 3.5 7.2 完全沉淀时 3.2 8.3 4.6 9.1
回答下列问题:
(1)在“脱硫”中PbSO4转化反应的离子方程式为,结合相关数据解释选择Na2CO3能使铅膏中PbSO4完全转化的原因。
(2)“酸浸”后溶液的pH为4.6,滤渣的主要成分是。
(3)研究人员发现所用Na2CO3中可能含有NaHCO3进行实验测定Na2CO3含量的方法如下:
步骤一:称取Na2CO3固体样品mg,用蒸馏水溶解,定容于250mL容量瓶中;
步骤二:移取25.00mL上述溶液于锥形瓶,加入2滴酚酞,用0.1000mol/L盐酸标准溶液滴定至第一滴定终点,消耗盐酸V1mL;
步骤三:在上述锥形瓶中再加2滴指示剂M,继续用0.1000mol/L盐酸标准溶液滴定至第二滴定终点,又消耗盐酸V2mL;
步骤四:平行测定三次,V1平均值为22.45,V2平均值为23.55。
①本实验中滴定管最适宜选取的碱式滴定管和酸式滴定管(填“25mL”或“50mL”)。
②步骤二中移取25.00mL待测液的正确操作为(选出正确操作并按序排列):检查是否漏水→蒸馏水洗涤→用待测液润洗2~3次→。
a.在滴定管下方放一个洁净的锥形瓶
b.记录初始读数V0
c.每次润洗后的溶液从滴定管上口倒入指定的烧杯中
d.每次润洗后的溶液从滴定管下口放入指定的烧杯中
e.加入待测液至“0”刻度以上
f.将乳胶管稍向上弯曲挤压玻璃球放液排除管尖气泡
g.放液,当管内液面的最低点与“25+V0”刻度相平时停止放液
h.调整滴定管内液面到“0”刻度或“0”刻度以下
③描述第一滴定终点前后颜色变化;指示剂M为。
④原Na2CO3固体中(填“是”或“否”)含NaHCO3,若有其质量为(若前空填“否”则此空不填)。
⑤某同学操作时第一滴定终点俯视读数,其他操作均正确,则Na2CO3的质量分数(填“偏大”“偏小”或“无影响”)。组卷:21引用:1难度:0.3


