2023-2024学年北京十五中高三(上)开学化学试卷
发布:2024/8/11 1:0:1
一、本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
-
1.下列装置工作原理与氧化还原反应无关的是( )
A. B. C. D. 



太阳能集热器 甲烷燃料电池 臭氧消毒柜 燃气灶 组卷:43引用:1难度:0.5 -
2.下列化学用语或图示表达不正确的是( )
组卷:5引用:1难度:0.8 -
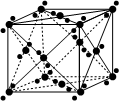 3.干冰(CO2)的晶胞结构如图所示。下列说法不正确的是( )组卷:259引用:4难度:0.7
3.干冰(CO2)的晶胞结构如图所示。下列说法不正确的是( )组卷:259引用:4难度:0.7 -
4.下列对于物质结构和性质的分析不正确的是( )
组卷:125引用:6难度:0.6 -
5.下列实验中的颜色变化,与氧化还原反应无关的是( )
A B C D 实验 NaOH溶液滴入FeSO4溶液中 石蕊溶液滴入氯水中 Na2S溶液滴入AgCl浊液中 热铜丝插入稀硝酸中 现象 产生白色沉淀,随后变为红褐色 溶液变红,随后迅速褪色 沉淀由白色逐渐变为黑色 产生无色气体,随后变为红棕色 组卷:1509引用:24难度:0.9 -
6.下列方程式能准确解释相应事实的是( )
组卷:42引用:5难度:0.7
二、本部分共5题,共58分。
-
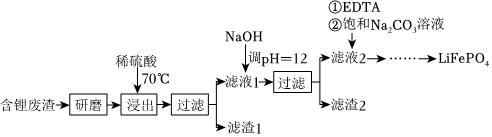
18.用含锂废渣(主要金属元素的含量:Li3.50%Ni6.55%Ca6.41%Mg13.24%)制备Li2CO3,并用其制备Li+电池的正极材料LiFePO4。部分工艺流程如图:
资料:ⅰ.滤液1、滤液2中部分离子的浓度(g⋅L-1):
ⅱ.EDTA能和某些二价金属离子形成稳定的水溶性络合物。Li+ Ni2+ Ca2+ Mg2+ 滤液1 22.72 20.68 0.36 60.18 滤液2 21.94 7.7×10 0.08 0.78×10-3
ⅲ.某些物质的溶解度(S):
Ⅰ.制备Li2CO3粗品T/℃ 20 40 60 80 100 S(Li2CO3)/g 1.33 1.17 1.01 0.85 0.72 S(Li2SO4)/g 34.7 33.6 32.7 31.7 30.9
(1)上述流程中为加快化学反应速率而采取的措施是。
(2)滤渣2的主要成分有。
(3)向滤液2中先加入EDTA,再加入饱和Na2CO3溶液,90℃充分反应后,分离出固体Li2CO3粗品的操作是。
Ⅱ.纯化Li2CO3粗品
(4)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO3溶液制备高纯度的LiOH。电解原理如图所示,阳极的电极反应式是,该池使用了(填“阳”或“阴”)离子交换膜。请结合电极反应式,解释高浓度LiOH溶液产生的原因:。后续再转化得电池级Li2CO3。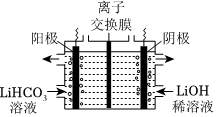
Ⅲ.制备LiFePO4
(5)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式是。组卷:2引用:1难度:0.4 -
19.某小组研究溶液中Fe2+与NO2-、NO3-的反应。
资料:[Fe(NO)]2+在溶液中呈棕色。实验Ⅰ 试剂 现象 滴管 试管 
1 mol•L-1FeSO4溶液
(pH=4)1 mol•L-1 NaNO2溶液(pH=8) a.滴入1滴FeSO4溶液,溶液变黄色,继续滴加,溶液变为棕色。2小时后,无明显变化 1 mol•L-1NaNO3溶液(加NaOH溶液至pH=8) b.持续滴加FeSO4溶液,无明显变化。
(1)研究现象a中的黄色溶液。
①用溶液检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+.乙认为O2不是主要原因,理由是。
③进行实验Ⅱ,装置如图。左侧烧杯中的溶液只变为黄色,不变为棕色,右侧电极上产生无色气泡,经检验该气体为NO.产生NO的电极反应式是。
实验Ⅱ的目的是。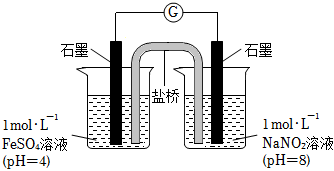
(2)研究现象a中的棕色溶液。
①综合实验Ⅰ和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是。
②加热实验Ⅰ中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释产生红褐色沉淀的原因是。
(3)研究酸性条件下,溶液中Fe2+与NO2-、NO3-的反应。
①ⅰ中溶液变为棕色的离子方程式是序号 操作 现象 ⅰ 取1mol•L-1的NaNO2溶液,加醋酸至pH=3,加入1mol•L-1FeSO4溶液 溶液立即变为棕色 ⅱ 取1mol•L-1的NaNO3溶液,加醋酸至pH=3,加入1mol•L-1FeSO4溶液 无明显变化 ⅲ 分别取0.5mL 1mol•L-1的NaNO3溶液与1mol•L-1的FeSO4溶液,混合,小心加入0.5mL浓硫酸 液体分为两层,稍后,在两层液体界面上出现棕色环 、。
②ⅲ中出现棕色的原因是。
实验结论:本实验条件下,溶液中NO2-、NO3-的氧化性与溶液的酸碱性等有关。组卷:234引用:3难度:0.1


