2022-2023学年重庆市文理学院附中高二(上)第一次月考化学试卷
发布:2024/9/26 0:0:1
一、单选题(48分,每小题只有一个正确选项)
-
1.“蓝天保卫战”,是党的十九大作出的重大决策部署,事关经济高质量发展和美丽中国建设。下列做法不利于打赢“蓝天保卫战”的是( )
组卷:23引用:4难度:0.6 -
2.光气又称碳酰氯,有剧毒,可发生反应:COCl2(g)⇌CO(g)+Cl2(g)△H>0.当反应达到平衡时,下列措施不能提高COCl2转化率的是( )
组卷:37引用:5难度:0.6 -
3.下列反应中△H>0,△S>0的是( )
组卷:219引用:6难度:0.6 -
4.下列热化学方程式及其有关叙述正确的是( )
组卷:57引用:8难度:0.6 -
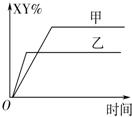 5.在密闭容器中,反应X2(g)+Y2(g)⇌2XY(g)△H<0达到甲平衡,仅改变某一条件后,达到乙平衡.对此过程的分析正确的是( )组卷:37引用:4难度:0.5
5.在密闭容器中,反应X2(g)+Y2(g)⇌2XY(g)△H<0达到甲平衡,仅改变某一条件后,达到乙平衡.对此过程的分析正确的是( )组卷:37引用:4难度:0.5
二、填空题(52分,每小题只有一个正确选项)
-
15.Ⅰ.一定条件下,体积为1L的密闭容器中发生如下反应:SiF4(g)+2H2O(g)⇌SiO2(s)+4HF(g)ΔH═+148.9kJ•mol-1。
(1)下列各项中能说明该反应已达化学平衡状态的是(填字母序号)。
A.v消耗(SiF4)═4v生成(HF)
B.容器内气体压强不再变化
C.容器内气体的总质量不再变化
D.HF的体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1)所示。
通过a或b的值及化学平衡原理说明t1时反应是否达到化学平衡状态:反应时间/min n(SiF4)/mol n(H2O)/mol 0 1.20 2.40 t1 0.80 a t2 b 1.60 。
Ⅱ.碳及其化合物有广泛的用途。
(3)反应C(s)+H2O(g)⇌CO(g)+H2(g)ΔH═+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是。
A.增加碳的用量
B.升高温度
C.用CO吸收剂除去CO
D.加入催化剂
(4)已知:C(s)+CO2(g)⇌2CO(g)ΔH═+172.5kJ•mol-1。则反应CO(g)+H2O(g)⇌CO2(g)+H2(g)的ΔH═kJ•mol-1。
(5)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),得到如下数据:
①其它条件不变,降低温度,达到新平衡前v(逆)t/min 2 4 7 9 n(H2O)/mol 0.12 0.11 0.10 0.10 v(正)(填“>”、“<”或“═”);
②该温度下,此反应的平衡常数K═;
③其它条件不变,再充入0.1molCO和0.1molH2O(g),平衡时CO的体积分数(填“增大”、“减小”或“不变”)。组卷:0引用:2难度:0.5 -
16.将浓度均为0.01 mol/L 的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
【资料】
该“碘钟实验”的总反应:H2O2 +2S2O32-+2H+═S4O62-+2H2O
反应分两步进行:
反应A:H2O2 +2I-+2H+═I2+2H2O
反应B:……
(1)反应B的离子方程式是。对于总反应,I-的作用相当于。
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
试剂X是。
试剂
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ。
(溶液浓度均为0.01 mol/L)
溶液从混合时的无色变为蓝色的时间:实验Ⅱ是30 min、实验Ⅲ是40 min。用量(ML)
序号H2O2
溶液H2SO4
溶液Na2S2O3
溶液KI溶液
(含淀粉)
H2O实验Ⅱ 5 4 8 3 0 实验Ⅲ 5 2 x y z
①实验Ⅲ中,x、y、z所对应的数值分别是。
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验Ⅳ.(溶液浓度均为0.01 mol/L)
实验过程中,溶液始终无明显颜色变化。用量(mL)
号
试剂H2O2
溶液H2SO4
溶液Na2S2O3
溶液KI溶液(含淀粉)
H2O实验Ⅳ 4 4 9 3 0
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验Ⅳ未产生颜色变化的原因:。组卷:132引用:17难度:0.5


