鲁科版(2019)选择性必修1《1.1 化学反应的热效应》2023年同步练习卷(8)
发布:2024/8/17 18:0:1
一、选择题
-
1.下列变化中的热量是中和热的是( )
组卷:15引用:2难度:0.5 -
2.下列关于燃烧热的说法正确的是( )
组卷:297引用:8难度:0.9 -
3.为了测定酸碱反应的中和热,计算时至少需要的数据是( )
①酸的浓度和体积;
②碱的浓度和体积;
③比热容;
④反应后溶液的质量;
⑤生成水的质量;
⑥前后温度的变化;
⑦操作所需时间.组卷:33引用:3难度:0.7 -
4.氢气和氧气发生反应的过程,可用如下模型表示(“-”表示化学键),下列说法不正确的是( )
 组卷:61引用:6难度:0.6
组卷:61引用:6难度:0.6
三、解答题
-
12.依据事实写出下列反应的热化学方程式:
(1)1molC2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1366.8kJ热量。
(2)1molC(石墨,s)与适量H2O(g)完全反应生成CO(g)和H2(g),吸收131.3kJ热量。
(3)25℃,101kPa条件下,1g甲醇燃烧生成CO2(g)和H2O(l)放热22.68kJ,则甲醇的燃烧热的热方程式为。组卷:12引用:2难度:0.7 -
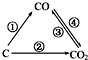 13.随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
13.随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可为;图中变化过程哪些是吸热反应(填序号).
(2)把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)═CO2(g)△H1<0;①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)═CO(g)+H2(g)△H2>0;②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g)△H3<0,③
2H2(g)+O2(g)═2H2O(g)△H4<0.④
则途径Ⅰ放出的热量(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量;△H1、△H2、△H3、△H4的数学关系式是.
(3)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g)⇌CH3OH(g) 方法二 CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
在25℃、101kPa下,1克甲醇完全燃烧放热22.68kJ,写出甲醇燃烧的热化学方程式:;
(4)金属钛冶炼过程中其中一步反应是将原料金红石转化:
TiO2(金红石)+2C+2Cl2TiCl4+2CO高温
已知:C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
TiO2(s)+2Cl2(g)═(s)+O2(g)△H=+141kJ•mol-1
则TiO2(s)+2Cl2(g)+(s)═(s)+(g)的△H=.
(5)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂.臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如
(s)+O3(g)═3Ag2O(s)△H=-235.8kJ•mol-1,
已知:2Ag2O(s)═4Ag(s)+O2(g)△H=+62.2kJ•mol-1,
则O3转化为O2的热化学方程式为.组卷:26引用:3难度:0.5


