人教版(2019)选择性必修1《2.4 化学反应的调控》2023年同步练习卷(1)(1)
发布:2024/8/16 17:0:1
一、选择题
-
1.下列有关以H2和N2为原料气的工业合成氨反应的说法不正确的是( )
组卷:14引用:4难度:0.5 -
2.已知合成氨反应N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1,将1mol N2和3mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量(忽略能量损失)( )
组卷:21引用:3难度:0.7 -
3.合成氨工业中,下列措施有利于提高反应物的平衡转化率的是( )
组卷:8引用:2难度:0.5 -
4.合成氨时,既要使原料的转化率增大,又要使反应速率加快,可采取的办法是( )
①减压
②加压
③升温
④降温
⑤及时从平衡混合气体中分离出NH3
⑥循环N2和H2
⑦加催化剂组卷:138引用:2难度:0.6 -
5.工业上合成氨采用500℃左右的温度,其原因是( )
①适当加快NH3的合成速率②提高氢气的转化率③提高氨气的转化率④催化剂在500℃左右活性最好组卷:41引用:2难度:0.5 -
6.汽车尾气处理反应为:2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H<0.下列措施不利于提高尾气处理效率的是( )
组卷:25引用:3难度:0.8 -
7.1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而满足了当时日益增长的人口对粮食的需求.下列是哈伯法的流程图,其中为提高原料转化率而采取的措施是( )
 组卷:275引用:29难度:0.7
组卷:275引用:29难度:0.7
二、解答题
-
20.氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。甲烷水蒸气催化重整是制高纯氢的方法之一。
(1)反应器中初始反应的生成物为H2和CO2,其物质的量之比为4:1,甲烷和水蒸气反应的方程式是。
(2)已知反应器中还存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g)△H1
ii.CO(g)+H2O(g)=CO2(g)+H2(g)△H2
iii.CH4(g)=C(s)+2H2(g)△H3
……
反应iii为积炭反应,利用△H1和△H2计算△H3时,还需要利用(写化学方程式)反应的△H。
(3)反应物投料比采用n(H2O):n(CH4)=4:1,大于反应的计量数之比,目的是(填字母)。
a.促进CH4转化 b.促进CO转化为CO2 c.减少积炭生成
(4)用CaO可以去除CO2.H2体积分数和CaO消耗率随时间变化关系如图所示。从t1时开始,H2体积分数显著降低,单位时间CaO消耗率(填“升高”“降低”或“不变”)。此时CaO消耗率约为35%,但已失效,因为此时CaO主要发生了(写化学方程式)反应而使(1)中反应平衡向移动。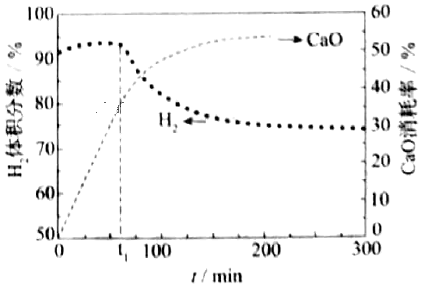
(5)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。其中物质a是,电源负极电极反应为。“钝化”装置中阳极电极反应为。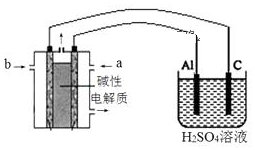 组卷:11引用:2难度:0.6
组卷:11引用:2难度:0.6 -
21.国际社会发出落实《巴黎协定》,推动绿色低碳转型,构建人类命运共同体的积极信号。生态工业和循环经济成为综合解决人类资源、环境和经济发展的一条有效途径。
(1)水是“生命之基质”,是“永远值得探究的物质”。
以铂阳极和石墨阴极设计电解池,通过电解NH4HSO4溶液产生(NH4)2S2O8,再与水反应得到H2O2,其中生成的NH4HSO4可以循环使用。
①阳极的电极反应式是。
②制备H2O2的总反应方程式是。
(2)CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41.2kJ•mol-1
反应Ⅱ:2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=-122.5kJ•mol-1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图1。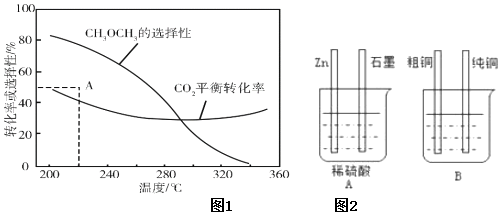
其中:CH3OCH3的选择性=×100%2×CH3OCH3的物质的量反应的CO2的物质的量
①温度高于300℃,CO2平衡转化率随温度升高而上升的原因是。
②220℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图1中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有。
(3)废物再利用。如图2装置加以必要的导线连接后达到利用粗铜精炼目的。
①A烧杯是。(填“电解池”或“原电池”)
②其中Zn接B烧杯中的,(填“粗铜”或“纯铜”),B烧杯中应该盛溶液。
③分别写出石墨棒和纯铜棒的电极反应式
石墨棒:,纯铜棒:。组卷:42引用:5难度:0.3


