氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。甲烷水蒸气催化重整是制高纯氢的方法之一。
(1)反应器中初始反应的生成物为H2和CO2,其物质的量之比为4:1,甲烷和水蒸气反应的方程式是CH4+2H2O 催化剂 4H2+CO2CH4+2H2O 催化剂 4H2+CO2。
(2)已知反应器中还存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g)△H1
ii.CO(g)+H2O(g)=CO2(g)+H2(g)△H2
iii.CH4(g)=C(s)+2H2(g)△H3
……
反应iii为积炭反应,利用△H1和△H2计算△H3时,还需要利用2H2(g)+CO2(g)=C(s)+2H2O(g)或C(s)+CO2(g)=2CO(g)2H2(g)+CO2(g)=C(s)+2H2O(g)或C(s)+CO2(g)=2CO(g)(写化学方程式)反应的△H。
(3)反应物投料比采用n(H2O):n(CH4)=4:1,大于反应的计量数之比,目的是abcabc(填字母)。
a.促进CH4转化 b.促进CO转化为CO2 c.减少积炭生成
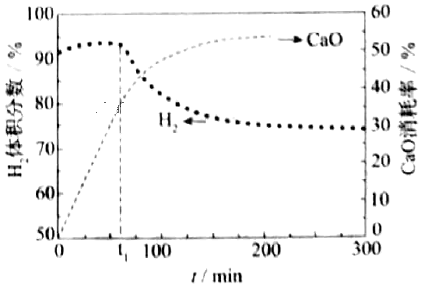
(4)用CaO可以去除CO2.H2体积分数和CaO消耗率随时间变化关系如图所示。从t1时开始,H2体积分数显著降低,单位时间CaO消耗率降低降低(填“升高”“降低”或“不变”)。此时CaO消耗率约为35%,但已失效,因为此时CaO主要发生了CaO+H2O=Ca(OH)2CaO+H2O=Ca(OH)2(写化学方程式)反应而使(1)中反应平衡向逆方向逆方向移动。
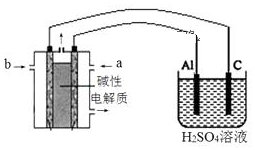
(5)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。其中物质a是氧气(O2)氧气(O2),电源负极电极反应为CH3OH-6e-+8OH-═CO32-+6H2OCH3OH-6e-+8OH-═CO32-+6H2O。“钝化”装置中阳极电极反应为2Al-6e-+3H2O=Al2O3+6H+2Al-6e-+3H2O=Al2O3+6H+。
催化剂
催化剂
【答案】CH4+2H2O 4H2+CO2;2H2(g)+CO2(g)=C(s)+2H2O(g)或C(s)+CO2(g)=2CO(g);abc;降低;CaO+H2O=Ca(OH)2;逆方向;氧气(O2);CH3OH-6e-+8OH-═CO32-+6H2O;2Al-6e-+3H2O=Al2O3+6H+
催化剂
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/16 17:0:1组卷:11引用:2难度:0.6
相似题
-
 1.第五主族的磷单质及其化合物在工业上有广泛应用.
1.第五主族的磷单质及其化合物在工业上有广泛应用.
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H已知相同条件下:4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H12Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)△H2SiO2(s)+CaO(s)=CaSiO3(s)△H3用△H1、△H2和△H3表示△H,则△H=;
(2)白磷与氧气反应生成P4O10固体.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P═O c kJ•mol-1、O═O d kJ•mol-1.根据图1的分子结构和有关数据通过计算写出该反应的热化学方程式为.
(3)三聚磷酸可视为三个磷酸分子(磷酸结构式如图2)之间脱去两个水分子产物,其结构式为,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为.
(4)次磷酸(H3PO2)为一元酸,分子中含一个羟基,其钠盐的正盐的化学式为,该盐可用于工业上的化学镀镍.①化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a)□Ni2++□H2PO2-+□=□Ni++□H2PO3-+□
(b)6H2PO-2+2H+=2P+4H2PO3-+3H2↑请在答题卡上写出并配平反应式(a);
②利用①中反应可在塑料镀件表面沉积镍-磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀.请从以下方面比较化学镀与电镀.原理上的不同点:;化学镀的优点:.发布:2024/11/19 8:0:1组卷:77引用:2难度:0.1 -
2.已知在1200℃时,天然气脱硫工艺中会发生下列反应:
①H2S(g)+O2(g)═SO2(g)+H2O(g) ΔH132
②2H2S(g)+SO2(g)═S2(g)+2H2O(g) ΔH232
③H2S(g)+O2(g)═S(g)+H2O(g) ΔH312
④2S(g)═S2(g) ΔH4
则ΔH4的正确表达式为( )发布:2024/12/6 13:30:1组卷:393引用:6难度:0.5 -
3.氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.联氨(又称肼,N2H4或H2N-NH2,无色液体)是一种应用广泛的化工原料,可用作火箭燃料.回答下列问题:
(1)联氨分子的电子式为,其中氮的化合价为;
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,该反应中还原剂与氧化剂的物质的量之比为2:1,反应的化学方程式为.
(3)①2O2(g)+N2(g)═N2O4(g)△H1
②ON2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
④N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=-1038.6kJ•mol-1
上述反应热效应之间的关系式为△H4=,联氨和N2O4可作为火箭推进剂的主要原因为.
(4)联氨可用作火箭燃料,燃烧时发生的反应是N2O4(l)+2N2O4(l)═3N2(g)+4H2O(g)△H=-1038.6kJ•mol-1,若该反应中有4molN-H键断裂,则反应放出的热量为kJ.发布:2024/11/18 8:0:1组卷:12引用:0难度:0.9


